一、发展简史
流式细胞术(flow cytometry,FCM)是一种可以对悬浮的单个细胞或其亚细胞结构的理化特性进行多参数快速测量的新型分析技术和分选技术。流式细胞术综合了流体力学、激光技术、计算机技术、细胞化学、图像技术等多领域的知识和成果,被认为是除了航空航天技术以外,美国科学家对人类现代科技文明作出的又一重大贡献;其工作平台——流式细胞仪也成为科学技术含量最高的测量仪器之一。
与其他许多科学技术的发展一样,流式细胞术的出现也有一段耐人寻味的发展史。显微镜技术、血球计数仪原理及应用于打印机的喷墨技术中的巧妙构思及灵感构成了第一台流式细胞仪的技术基础。
Andrew Moldavan是第一位尝试在静止的显微镜检测技术中引入流动系统的先驱。1934年,他构想了一种设备,将流动的红细胞和中性红染色的酵母细胞通过设置于显微镜平台上的毛细玻璃管,连接于目镜上的光电检测器记录每一个流动通过毛细玻璃的细胞从而达到计数的目的。虽然Moldavan的设想是否真的付诸实施现已无从了解,但随后30年发展起来的染色技术使人们意识到Moldavan所描述的这种细胞计数仪将不仅仅能用于细胞的计数,而且还能对细胞的多种特性进行检测。
20世纪60年代中期,具有光学领域研究背景的Louis Kamentsky参考了Moldavan的设想,制造了一台以显微镜为基础的分光光度计。他用此仪器能够检测并记录以高速(每秒500个细胞以上)流经显微镜物镜细胞的紫外吸收及散射信号。1967年,Kamentsky和Melamed在原来设计的基础上进一步加工制造了细胞分选仪。该设备可通过电信号激活的吸引器将目的细胞(吸收/散射比值高)从液流中分选出来,然后可以对这些感兴趣的细胞用显微镜进行详细观察。
1969年,德国的Dittrich和Ghde在基于显微镜的系统上设计了流动室,可以对乙醇固定后并以溴化乙锭(EB)对DNA染色的细胞进行检测并做出荧光强度的直方图。同一时期,Wallace Coulter建立了关于血细胞分析的“库尔特原理(Coulter theory)”——液流中单个细胞快速通过微孔时,由于细胞的体积大小不同引起电阻也不同,电子检测器接收到信号后由仪器自动地按电阻的不同对细胞按体积大小进行分类。这些对细胞的分析方法实际上与现在的流式细胞术的原理已十分近似了。
在Kamentsky致力于其研究的同时,美国新墨西哥州Los Alamos实验室的Mack Fulwyler正在试图解决用当时的Coulter血球计数仪检测红细胞时使许多人困扰的一个问题——在显微镜下观察时,红细胞的形态表现为高度一致性;而用当时的Coulter血细胞计数仪检测时,按电阻大小分类的红细胞却呈现明显的双峰分布。这种现象是形态高度一致的红细胞中确实存在两类特性不同的群体,还是检测电阻过程中造成的一种假象?Fulwyler采取的最直接方法就是按电阻大小的不同将两群红细胞分选出来,然后再分别重新进行检测,观察两群红细胞各自是否还会出现双峰分布现象。
Fulwyler采用库尔特原理结合喷墨技术来实现不同电阻大小的两群红细胞的分选。喷墨技术的要点是通过喷嘴的高频振荡,使经过喷嘴的墨水形成不连续的分开的微小墨滴,随即墨滴又被充电带上电荷。在实现打印目的时,带电的墨滴根据计算机所要打印的信息而发生适当的方向偏转,从而在纸上形成所需要的图案和字符。Fulwyler在库尔特液流技术的基础上采用喷墨技术的原理,研究设计了一种设备,该仪器可以对包含细胞的液滴进行充电,使之带有电荷。然后,根据细胞电阻测定的信号使液滴(内含细胞)发生方向偏转,实现不同电阻大小红细胞的分离。
Fulwyler实验的结果当然就是我们现在众所周知的,红细胞为形态高度一致的双凹圆盘状(非球形)细胞,因此造成了电阻测定时形成双峰的假象。但是他所采用的实验技术却是液流分选技术发展过程中的一个里程碑。Fulwyler的实验对于我们今天的流式细胞术专家仍有很大借鉴作用的一点就是,流式细胞术中的信号(特别是有关细胞形态和体积的信号)有时是受假象干扰的,并能真实反映细胞的本质特征;这时,显微镜观察是必不可少的。
1953年,伦敦Middlesex医院的Crosland-Taylor意识到计数液流中悬浮小颗粒的技术仍有缺陷。选用粗的管道时,往往会造成数个颗粒并肩通过检测点;选用细的管道时也因玻璃管道和液流的不同折射率而使显微镜观察多有不便,更何况细管道经常会发生堵塞。Crosland-Taylor采用层流原理设计了一个液流系统,将红细胞悬液注入高速流动的液流中央,这样红细胞就逐个排列成一列被限制在高速液流的中轴并在粗的管道中流动。这个液流聚焦的原理在流式细胞术的发展历程中是极为关键的。
1969年,美国Los Alamos实验室的Marvin Van Dilla和他的同事设计制造了世上第一台采用氩离子激光器为光源,液流聚焦的流动系统的荧光检测细胞仪。这一设备兼有Kamentsky仪器的光照和电信号检测及Fulwyler细胞分选仪中振动喷嘴等要素,是现代流式细胞仪的雏形。他们用这台仪器检测中国仓鼠卵巢细胞(CHO)和白细胞DNA荧光染色后的荧光信号及细胞大小。当时,他们预计这种方法可能很快会被推广使用,而且有很大的潜在应用价值。而事实也正是如此,不久之后,Stanford大学的Herzenberg研究小组发表的论文中描述了他们用类似的设备按荧光信号的不同对小鼠脾细胞和中国仓鼠卵巢细胞做了分选。两个小组的仪器都把荧光信号、光散射信号及细胞大小多个参数与细胞分选结合了起来。起初这些仪器被用来寻找区分和分离白细胞的可靠方法,而到20世纪60年代末,研究者们已经能够分选得到高纯度的淋巴细胞和粒细胞。
至此,流式细胞术发展史中接下来的事情主要包括流式细胞技术的进一步细化加工、流式细胞术多种应用的开发,以及研究者们和厂家合作共同开发方便用户操作的商品化流式细胞仪。当商品化的流式细胞仪在市场上出现的时候,流式细胞术的研究和发展仍在美国新墨西哥州的Los Alamos、加利福尼亚州的Livermore国家实验室及世界各地较小些的实验室中继续着。这些研究中心自主设计制造的流式细胞仪继续引领着这一技术最前沿的发展方向。同时,流式细胞术也正向两个方向发展着。一方面,把这一技术推向更尖端,更加精确地测定和分析更多种类微粒的更多的特性,并且以更快的速度根据这些特性来分选目的细胞。另一方面是通过不断革新,以使流式细胞仪更方便用户操作。
二、基本原理
流式细胞仪的基本原理就是通过气体压力使悬浮于液体中的细胞或颗粒进入流动室,由于液流聚焦作用及鞘液的约束作用而使细胞或颗粒逐个排成单列在鞘液中高速流动。流经激光检测点时,细胞或颗粒在激光的激发下产生散射光信号及荧光信号,信号由检测器收集并输入电脑进行数据处理。如果流式细胞仪带有分选功能,可以使我们感兴趣的目的细胞带上电荷,带电荷的目的细胞在电磁场中发生方向偏转从而与其他细胞分开,达到分选纯化的目的。
(一)流式细胞仪的结构
流式细胞仪分为液流系统、光学系统、数据处理系统及分选系统4部分。
1.液流系统 细胞悬液和鞘液在气体压力的作用下进入流动室(图4-1)。细胞悬液注入鞘液后,在鞘液的约束作用下位于鞘液流的中央。液流经过流动室出口处狭小的喷嘴时,液流变细。如果此时符合层流条件,细胞将逐个排成单列,在鞘液流的中央平稳地快速流动。

图4-1 流式细胞仪的液流系统
气体压力将细胞悬液和鞘液同时压入流动室
液流能否形成层流由Reynolds系数决定,公式如下。
![]()
式中,d为管径(tube diameter),ρ为液体密度(density of fluid),v为液流平均速度(mean velocity of fluid),η为液体黏度(viscosity of fluid)。Re系数<2 300,能够形成层流;Re系数≥2 300,则液流层被扰乱。
2.光学系统及光学检测系统 光学系统包括激光光源、色散棱镜、滤光片;检测系统包括散射光检测器和荧光检测器。
(1)流式细胞仪:多采用激光作为光源,因为激光具有单波长,高强度和高稳定性的特点。一般以氩离子激光器(488nm)最为普遍,其他常用的还有氦氖激光器或红色二极管激光器(633nm)和紫外激光器。
(2)色散棱镜:用来选择激光的波长,调整反射镜的角度使调谐到所需要的波长。
(3)滤光片:可以选择性地使某一滤长区段的光线滤除或通过,从而使不同波长范围的荧光分别进行检测。滤光片分为长通滤光片(允许一定波长以上的荧光通过)、短通滤光片(允许一定波长以下的荧光通过)、带通滤光片(允许一定波长范围内的荧光通过)、双向长通滤光片(一定波长以上的荧光通过,其余荧光反射至另一方向)。
(4)光信号:当细胞流经激光检测点时,产生两种光信号——细胞本身对激光的散射产生的散射光和荧光素经激光的激发后产生的荧光。前向散射光由设置于激光前方的前向光电二极管检测,侧向散射光和荧光由设置于激光90°方向的光电倍增管检测。侧向的散射光和荧光经过各种滤光片的选择后分别到达各自的检测器。光电检测器将光信号转变为电信号,较弱的电信号经由线性放大器或对数放大器的放大后输入数据处理系统。
3.数据处理系统 经放大后的电信号被送往计算机,信号再经模-数转换器输往微机处理器编成数据文件贮于计算机的硬盘上,以备调用。存贮于计算机内的数据可以在实测后脱机重现,进行数据处理和分析,最后给出结果。
4.分选系统 大型的科研型的流式细胞仪带有分选系统。高频振动的流动室使鞘液流断开形成液滴,细胞包含在液滴中。仪器可以为不同属性的感兴趣的目的细胞所在液滴充电,产生带电荷多的液滴,带电荷少的液滴和不带电荷的液滴。这样,这些带不同电荷的液滴在电磁场中发生方向偏转,可以分五路进行收集。
(二)流式细胞术的参数
流式细胞术是对细胞在激光激发下产生的散射光和荧光信号进行收集与分析,从而得到细胞的理化特性。
1.散射光信号 散射光信号主要反映细胞的物理特性,分为前向角散射光和侧向角散射光。
(1)前向角散射光:激光照射至检测点,顺着激光前行的方向设置有一个检测器,用于收集检测点细胞向前方发出的散射光信号。前向角散射光参数反映了细胞的大小。
(2)侧向角散射光:从激光检测点出发,沿着激光行进路线90°方向设置有一系列检测器,分别收集侧向角散射光和荧光信号。侧向角散射光信号反映了细胞的粒度,即细胞内部的复杂程度,包括细胞质内颗粒的多少、细胞核的规则程度等。当然,侧向角散射光信号也与细胞的形状和大小有关,但这些并不是侧向散射光信号反映的信息的主要面。
2.荧光信号 荧光信号分自发荧光信号和特征荧光信号。自发荧光即不经荧光染色,细胞内部的荧光分子经光照射后所发出的荧光。特征荧光是由对细胞进行染色的特异性荧光染料受激光激发后而发射的。每种荧光染料都有其特定的激发波长,荧光染料受激光激发后也都有其特定的发射波长。流式细胞仪利用各种不同波长的光学滤片来收集荧光信号。
自发荧光信号为噪声信号,一般会干扰对特异荧光信号的分辨和测量。在免疫细胞化学等测量中,对于结合水平不高的荧光抗体来说,如何提高信噪比是个关键。自发荧光的强弱通常与细胞成分中能够产生的自发荧光的分子(如维生素B2、细胞色素等)的含量、培养细胞中死细胞/活细胞比例及细胞样品中所含亮细胞的比例相关。
一般在进行免疫学测量时,荧光信号用对数来显示。这是由于用使用对数放大器对荧光信号进行放大时,被染色的细胞群体呈正态分布趋势,有利于阴性和阳性细胞群体的判断。
(三)流式细胞术数据显示方式
流式细胞术的结果是由计算机系统将检测到的各种参数电信号转换为数字,编译为数据文件进行保存。由于数据文件缺乏直观性,为了便于操作者观察,计算机系统通过软件将数据转换成各种直观的图形。
1.单参数数据的显示 单参数直方图是一维数据用得最多的图形。横坐标表示散射光或荧光信号强度的相对值,以荧光道数表示。信号强度分布可以是线性的,也可以是对数的,但荧光信号因通常呈对数正态分布,故荧光信号常以对数表示。图的纵坐标以细胞数或细胞出现的频数来表示(图4-2)。

图4-2 单参数直方图(为对数分布直方图)
2.双参数数据的显示 细胞的双参数测定不仅包含了两个独立参数各自与细胞数量的关系,更为重要的是,还包括了这两个参数之间的相互关系。双参数数据的显示可有散点图、等高线轮廓图、密度图及假三维图等。
(1)形象地说,在双参数散点图上的每个点不但同时包含了横、纵两坐标各自所代表的参数的信息,而且还能反映出两个参数的相互关系。因此,双参数测定的二维点图所包含的生物学信息非两个单参数测定的一维直方图信息的总和所能及的(图4-3)。
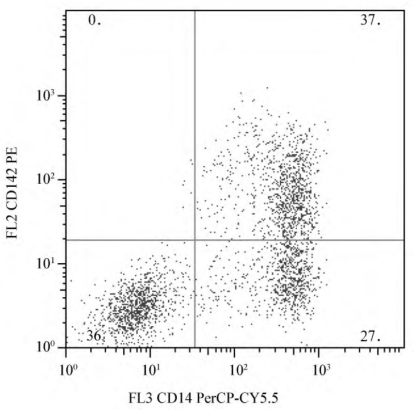
图4-3 双参数二维点图
(2)等高线轮廓图类似于用等高线绘制的地理图。散点图是用点的密集和稀疏来反映被分析颗粒参数值的集中和离散情况,而在等高线轮廓图上则是通过代表不同细胞数的曲线轮廓来显示(图4-4)。
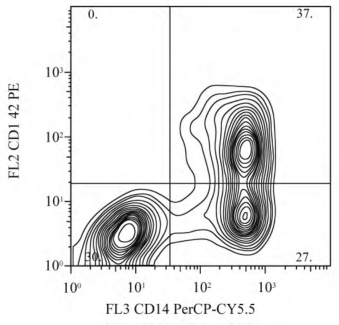
图4-4 等高图
(3)假三维图中X轴、Y轴分别为两个不同的测定参数,Z轴为细胞数而非检测参数,故非真正意义的三维立体图。此种显示方法将二维图中所包含的数据集中和离散的信息进一步直观化(图4-5)。
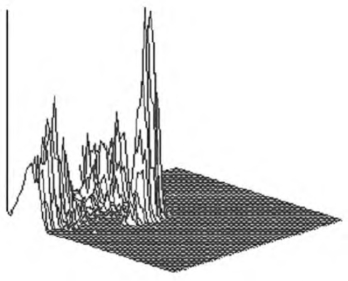
图4-5 假三维图
3.三参数数据的三维立体显示 三维图中的X轴、Y轴和Z轴分别表示不同的测定参数,是真正意义的三维立体图。可同时观察3个参数之间的相互关系(图4-6)。

图4-6 三维图
三、临床应用
(一)肿瘤的诊断
1.血液系统恶性肿瘤免疫分型 随着免疫学的发展,尤其是单克隆抗体技术的发明和应用,使人们对各种血细胞特征性抗原的检测成为可能。20世纪80年代初,人们除通过免疫分型进一步将髓系、单核系、淋巴系白血病分型外,突破性的进展是可以将急性淋巴细胞白血病区分为B细胞系和T细胞系,并分别对B细胞系和T细胞系急性白血病分期。随着各种新的特征性抗原的发现和单克隆抗体的制备,免疫表型分析也不断地深入发展,而且免疫表型分析在白血病的诊断、预后判断及指导治疗方面起了重要作用。
(1)急性白血病免疫分型
①白血病免疫分型的基础:正常血细胞从多能干细胞分化、发育、成熟为功能细胞的过程中,细胞膜、细胞质或胞核抗原的出现,表达增多与减少甚至消失与血细胞的分化发育阶段密切相关,而且表现出与细胞系列及其分化程度相关的特性。这些细胞表面和细胞质内的抗原随着分化成熟过程不断发生改变,称为造血细胞分化抗原。分化抗原的表达情况可作为鉴别和分类血细胞的基础。
②白血病免疫分型的定义:白血病免疫分型是利用单克隆抗体(McAb)检测白血病细胞的细胞膜和细胞质抗原表达情况,以了解被测白血病细胞所属细胞系列及其分化程度。
我们除了对各系列特异性抗原的检测以确定白血病细胞的系列来源外,还需通过对一系列与细胞分化阶段相关的抗原的检测来确定白血病细胞分化程度。
免疫分型首先要从正常血细胞中把白血病细胞区分出来加以进一步的检测,但各类型白血病目前都尚未确定其肿瘤特异性抗原。尽管白血病免疫分型所检测的抗原都是正常血细胞同样表达的抗原,但我们可以根据白血病细胞抗原表达的异常特点将其与正常血细胞区分。
对应于正常血细胞抗原的表达情况,白血病抗原表达有如下的特点:其一,跨系表达。白血病细胞是一群抗原表达紊乱的恶性细胞,其抗原表达不再遵守系列保守性。如AML和BALL往往会表达T系抗原CD7,B-ALL和T-ALL也常会表达髓系抗原CD33或CD13。其二,时相混乱表达。白血病细胞抗原表达也常不遵守阶段规律性。如B-ALL有时会同时表达早期标志CD34和中晚期才出现的抗原胞质免疫球蛋白重链μ(cμ)。其三,抗原表达量的变化。白血病细胞相对于同类同阶段正常血细胞常常表现出抗原过度表达或弱表达的特点。如B-ALL中,CD45和CD38通常弱表达,而CD10往往过度表达;而T-ALL中,也常有CD7的过度表达。
③白血病免疫分型常用的指标:T淋巴细胞指标,如cCD3、CD7、CD2、CD5、CD4、CD8、TCRαβ、TCRγδ。B淋巴细胞指标,如cCD79a、CD19、CD22、CD10、cμ、sIgM。髓细胞指标,如MPO、CD117、CD13、CD33、CD14、CD64、CD15、Glycophorin A、CD41。
④急性白血病免疫分型结果分析:具体分下述几种情况。
急性淋巴细胞白血病:目前,对于ALL的免疫表型已经研究得很深入。通过免疫表型的分析,不仅能把ALL区分为B-ALL和T-ALL,而且还能对其进行分期(表4-1,表4-2)。
表4-1 EGIL对于B-ALL的分期标准

表4-2 EGIL对于T-ALL的分期标准

急性髓细胞白血:AML的免疫学诊断至今仍无重大突破。除了M6和M7可分别通过各自的特异性抗原Glycophorin A和CD41明确诊断外,其他M1~M5各型由于尚未找出其型特异性抗原(CD14与单核系相关,见于M4和M5,但阳性率并不是很高)而无法确切地分出免疫学亚型。M3也有其自身的特点:CD34和HLA-DR全为阴性,CD13的表达率较在其他各型高。因为CD13的出现晚于早期即出现的CD33,在其他各型白血病中,往往只有CD33高表达,CD13低表达;而在分化阶段较为成熟的M3中,CD13表达例数明显增多。
但值得一提的是,M0~M7毕竟是FAB形态学的分型标准(表4-3),免疫分型的标准无须刻意地附和形态学标准。即使将来对于AML有更好的免疫指标出现,也应该会建立免疫分型自己的诊断标准。目前,国外一些权威机构诊断AML时也并不需要免疫分型去按FAB形态学的分型标准出具报告,如某病例形态学诊断符合M3,免疫分型结果确认为AML,另外加上细胞遗传学结果为t(15;17),以及分子生物学检测中有无t(11;17)(q23;q11)累及的融合基因PLZF-RARα(对全反式维A酸治疗无反应)存在,即可做出明确的诊断并制订相应的治疗方案。
表4-3 AML各亚型的免疫表型特点

混合性白血病:混合性白血病中有一类为双表型混合性白血病,其特点是在白血病细胞上同时有几种不同系列抗原的表达。双表型白血病与Ly+AML和My+ALL的鉴别可以按以下记分系统进行(表4-4)。当两个系列的分值分别都>2时,则判断为双表型急性白血病。
表4-4 双表型急性白血病记分系统

(2)慢性淋巴细胞白血病(CLL)免疫表型
①表达:CD5、CD23、CD19、CD79a。
②弱表达或阴性:SIg、CD20、CD22、CD11c、CD10、cyclin D1、FMC、CD79b。
③典型特征:CD79b弱表达,CD5、CD23阳性。
CD23和cyclin D1在鉴别CLL和外套细胞淋巴瘤时有意义。CD38为CLL的预后指标。在免疫球蛋白基因未发生重排的病例中,CD38为阳性,预后差。
(3)毛细胞白血病(HCL)免疫表型
①表达:SIg、B细胞相关抗原(CD19、CD20、CD22和CD79a)、CD11c、CD25、FMC7和CD103。
②不表达:CD79b、CD5、CD10和CD23。
③典型特征:CD5、CD10和CD23阴性,CD11c和CD25强阳性,FMC7和CD103阳性。
(4)多发性骨髓瘤(MM)
①表达:单克隆胞浆Ig(多为IgG,有时为IgA,极少为IgD,IgE和IgM)、CD38、CD79a、CD138、CD56/CD58,有时伴有髓系抗原的表达。
②不表达或弱表达:大多不表达B系抗原CD19和CD20,不表达膜表面Ig,CD45弱表达。
③典型特征:表达胞质Ig,而不表达膜表面Ig;不表达CD19,表达CD38、CD56和CD138。浆细胞白血病的表型与MM相似,CD38+,单克隆胞质Ig+,但不表达CD56。
(5)套细胞淋巴瘤(MCL)
①表达:膜表面Ig、CD5、FMC-7、CD43、Bcl-2和cyclin D1。
②不表达:CD23、CD10。
③典型特征:SIg、CD5、cyclin D1阳性、CD23阴性,与CLL有明显区别。
2.神经母细胞瘤骨髓转移检测 神经母细胞瘤(neuroblastoma,NB)原发于交感神经组织,是儿童最常见的颅脑外实体瘤。其生物学、遗传学和形态学特性均表现出较大的异质性,且具有多种不同的临床表现。约40%NB患者可最终侵犯骨髓而发展到第四期,其5年生存率仅为30%。在治疗过程中,骨髓中出现NB细胞预示着复发或极差的临床结局。因此,检测骨髓中的NB细胞对于临床精确分期和危险度评估至关重要。
目前,国际上用流式细胞术检测NB较为常用的免疫指标为CD9、CD56、CD81+、GD2、CD45。抗体组合为CD9/CD81/CD45/CD56和GD2/CD81/CD45/CD56。此检测方法可以用于NB进展到第4期的诊断、与其他神经胶质瘤的鉴别诊断及微小残留病的监测。另外,GD2的表达与否是利用抗GD2抗体进行免疫生物靶向治疗的判断依据。
3.DNA倍体分析 DNA倍体分析可以协助诊断或鉴别诊断良、恶性肿瘤。异倍体(即染色体数目少于或多于二倍体细胞)细胞的存在可作为恶性肿瘤的诊断标准之一。即使是二倍体细胞,如果其S期比例或增殖指数增高也可为恶性肿瘤的诊断提供依据。对于肿瘤患者的预后判断也与异倍体和S期比例增高有关。
(二)肿瘤性疾病的预后判断和疗效监测
1.耐药基因产物检测 多药耐药(multidrug resistance,MDR)是指肿瘤细胞耐受多种不同的抗肿瘤药物的作用而得以生存的能力,是肿瘤治疗的主要障碍。特别是急性白血病,多药耐药意味着复发的可能性大为增加。
目前急性髓系白血病耐药的分子机制已较为明了。降低白血病细胞对于化疗药物的敏感性的机制中至少包括3种蛋白,即P糖蛋白(P-glycoprotein,PGP)、多药耐药相关蛋白(multidrug-resistance-associated protein,MRP)和肺耐药相关蛋白(lung resistance related protein,LRP)。它们都属于ATP酶活性转运蛋白,均是通过药物外排泵的作用降低细胞中药物的浓度。此类蛋白在肿瘤细胞中的高度表达,将降低抑制细胞生长的抗肿瘤药物作用的有效性。用流式细胞术可以检测此类蛋白的表达水平和功能。
(1)耐药相关蛋白表达水平的检测:用各种荧光标记的特异性抗体检测细胞膜表面耐药相关蛋白的表达量。可以有阳性细胞的百分比及阳性细胞的荧光强度两种表示方法,分别用于代表表达耐药相关蛋白的细胞的比例,以及耐药相关蛋白在细胞膜表面的表达程度。
(2)耐药相关蛋白功能的检测:与肿瘤耐药性最直接相关的是耐药相关蛋白的功能,而非耐药相关蛋白的表达数量。因此,要准确评估肿瘤细胞的耐药性,还需检测细胞表面的耐药相关蛋白是否具有生物活性。将肿瘤细胞和同组织来源的正常细胞对照经用能够渗入活性细胞内部的荧光染料(如罗丹明,Rh123)处理后,用流式细胞术观察细胞的荧光强度。如果肿瘤细胞表达耐药相关蛋白且该蛋白具有生物活性,细胞内部的荧光染料因被该蛋白的外排泵作用而排出胞外,从而使肿瘤细胞的荧光强度显著低于正常对照细胞。
2.染色体端粒长度检测 端粒为位于染色体的末端的DNA序列,在所有脊椎动物中,端粒都由几百至几千个(TTAGGG)重复序列构成。端粒的长度有种属特异性,人的端粒长度为5~20kb。端粒的功能主要是保持染色体末端的完整性,从而保护邻近基因并避免染色体末端的融合。有丝分裂前期,在DNA聚合酶的作用下,细胞DNA进行复制,但端粒区并不参与复制。因此,每次细胞分裂后,端粒长度都将缩短50~200bp,当端粒缩短到一定程度,不能维持染色体的稳定时,细胞发生衰老、凋亡。
但肿瘤细胞因端粒缩短而激活端粒酶,使端粒丢失的片段得到补偿,重新维持在一定的水平上,以保持其稳定和持续增殖。检测肿瘤细胞的端粒长度有助于评估肿瘤的恶性程度和预后。
端粒长度通常是通过Southern blot技术检测,但该方法较复杂且耗时。而近年建立的流式荧光原位杂交(Flow-FISH)方法,使端粒长度检测更为简便、快速和有效。Flow-FISH通过将荧光素标记的端粒互补序列作为探针,经杂交而结合至端粒。同时,通过PI染色选取二倍体细胞进行分析。在倍体细胞中,标记探针的荧光强度的强弱与端粒的长度呈正相关。如果同时用荧光标记抗体做免疫表型分析,则可以精确地选取目的细胞并分析其端粒长度。但Flow-FISH联合免疫表型分析方法的建立一直是一个技术难点。关键之一在于很难找到能够承受原位杂交条件(82℃的高温)而不失去其荧光热稳定性的荧光染料。当前,有不同的研究小组分别探索了应用光量子标记抗体和Alexa Fluor 488及Alexa Fluor 546标记抗体在Flow-FISH联合免疫表型分析中的应用,取得了较满意的结果。
3.调节性T细胞(Treg)检测 近年来,对机体免疫系统起重要调控作用的Treg备受关注。Treg除在自身免疫、感染性疾病及移植耐受中发挥作用外,目前研究显示,Treg与肿瘤发生、发展存在密切关系。对实体瘤的研究结果表明,Treg的高水平存在预示着预后差及存活率低。尔后的研究结果也表明,白血病初发患儿体内的Treg数量显著增高,且患儿中Treg表达水平与MRD有关联。高水平Treg预示白血病患儿的预后较差,存在复发的可能。
Treg最初被定义为CD4+CD25+细胞群,但这样难以区分CD4+CD25+Treg细胞和CD4+CD25+的活化效应T淋巴细胞。后来有学者发现Treg高表达CD25,但以CD4+CD25high来界定该细胞又因CD4+CD25high和CD4+CD25low之间并无明显的分界而很难在流式细胞术双参数图上客观加以区分。近来研究发现,转录因子Foxp3不仅在Treg发育和发挥功能中起重要作用,而且也是Treg的特异性标志,这为精确定量Treg带来了希望。在随后的研究中,有些研究组只选择评价CD4+T淋巴细胞中Foxp3+细胞的量,而不考虑CD25+细胞;而另一些研究组只评价CD4+CD25highT淋巴细胞中Foxp3+细胞的量。虽然两种方法得到的结论相同,但是实验方法不同,却使结果缺乏可比性。这表明除选择特异性的检测指标外,标准化的检测方法也十分重要。有学者在研究中发现,Foxp3虽然在CD4+CD25high细胞群中高表达,但在CD25弱表达,甚至在CD25表达阴性的CD4+T淋巴细胞中,Foxp3都有不同程度的表达。Wan等也指出,在小鼠中Foxp3+T淋巴细胞在体外发挥的抑制功能,并不依赖于CD25的表达。而人类CD4+CD25-T淋巴细胞经刺激诱导FOXP3基因表达后,也同样具备了Treg的功能。因此,可以认为,取所有CD4+T淋巴细胞分析其中Treg的比例更合适。
(三)微量肿瘤细胞监测
1.白血病微小残留检测 微小残留(minimal residual disease,MRD)检测的研究已日益成为急性白血病临床治疗的关键。最常用的微小残留检测方法是用PCR方法检测抗原受体基因的重排或融合基因的检测,以及用流式细胞术检测免疫表型的异常。
多年以来,单克隆抗体的质量和品种都有了较大的进步,流式细胞仪的功能有了大幅度的提升,尤其是近十年信息学取得了令人瞩目的进展,这些都极大地促进了以流式细胞术为基础的MRD检测工作的发展。流式细胞术MRD检测结果与患者临床特征及治疗的疗效有显著相关,因而被视为一种可靠的检测方法。
(1)流式细胞术检测MRD的优缺点:对于检测MRD,流式细胞术优于PCR的最明显的优势是流式细胞术可直接进行定量,而PCR是根据产物的量进行推算。仅此特点就使流式细胞术的定量更为简单直接,而且更为精确。另外,流式细胞术检测时可以区别活细胞、经化疗将要死亡的细胞及细胞碎片(而后者在PCR检测中都可能形成阳性信号)。
当然,与PCR方法相比,流式细胞术检测MRD也有其不足之处。首先,流式细胞术的极限敏感度为10-4,而PCR方法一般可达10-6。其次,在白血病进展过程中,白血病细胞的免疫表型可能会发生改变,如果表型的改变波及用于MRD监测的指标时,可能会造成假阴性的结果。这种潜在的不利影响的大小取决于适用于患者MRD监测的指标组合的数量。即如果有一种以上的适用指标组合存在,当其中一种抗原指标发生改变时,而其他指标并未发生改变,这样就可有效地防止假阴性的发生。另外,流式细胞术分析的结果与PCR不同,不是“有或无”的结果。这是因为流式细胞术一般是以抗原表达量的差异作为区分白血病细胞和正常细胞的依据。尽管如此,我们也可以通过以多个正常标本来确定正常细胞抗原表达的限度,同时避免应用可能使白血病细胞和正常细胞有部分重叠的指标组合,以使流式细胞术检测MRD成为可能。
(2)MRD检测指标的选择:用于MRD检测最理想的指标应该是只表达于白血病细胞,而正常骨髓细胞和外周血细胞都不表达。照此看来,融合基因所编码的蛋白如BCR-ABL、AML1-ETO等都是很好的检测指标,但目前还没有可靠的、适合于流式细胞术检测的商品化的抗体。
因此,目前用流式细胞术检测MRD时,选择抗原指标的原则是利用抗原表达的差异以直观的方式区分白血病细胞和骨髓中正常的早期细胞。抗原表达的差异主要包括:①质的差异,包括跨系表达的抗原、时相混乱的抗原及与染色体异常相关的抗原;②量的差异,包括表达量异常增高或异常降低的抗原。
确立MRD检测的有效免疫指标时还需要注意来自正常骨髓细胞的影响。如早期前体淋巴细胞在健康成年人骨髓中数量很少,而在儿童骨髓中或白血病患者骨髓移植后及化疗后的骨髓重建期的骨髓中数量较多。在这种情况下应注意不要将在正常个体中难以检测到的正常细胞误认为白血病细胞。
(3)MRD检测的灵敏度:影响流式细胞术检测白血病MRD检测灵敏度的最主要两个因素是:①目标细胞和其他正常细胞的免疫表型差异程度;②待分析的细胞总数。在理想的情况下,即目标细胞免疫表型与正常细胞有显著区别(用于监测指标的双参数散点图上白血病细胞和骨髓正常早期细胞分布范围无任何重叠),且待分析的细胞足够多时,流式细胞术所能达到的敏感度可为10-4。
2.神经母细胞瘤微小残留检测 参见本章第二节中“神经母细胞瘤”的相关内容。
3.循环微量肿瘤细胞检测 数十年来,医学研究多关注于肿瘤的发生机制、肿瘤的预防及原发部位肿瘤的诊治,并取得了令人瞩目的进展。但对于肿瘤的转移目前还缺乏有效的早期检测、早期诊断的手段。
肿瘤的转移包括一系列连续的环节,主要是肿瘤细胞播散进入血液循环,在血液循环中保持存活,从血液循环渗出并驻留在继发部位,在继发部位生长并逐渐形成临床可测知的转移瘤。了解了肿瘤转移各环节的特性后,就应该有可能在转移瘤生成之前达到早期检测、早期诊断和早期干预的目的。
在发生转移病变的肿瘤患者中,目前已可以用流式细胞术或核酸检测技术在外周血液循环中检测到循环肿瘤细胞(circulating tumor cells,CTCs)。越来越多的证据表明,肿瘤患者外周血液循环中检测到CTCs是肿瘤转移和预后差的重要标志。定量检测微量CTCs对于肿瘤转移可能性的评估、疗效评价、缓解后监测及预后判断具有极为重要的意义。
上皮特异性指标——细胞角蛋白因只表达于上皮来源的细胞而不表达于白细胞,曾被广泛用于流式细胞术检测血液循环中上皮来源的循环肿瘤细胞。但后来研究发现,血液循环中并非所有细胞角蛋白阳性的细胞都是肿瘤细胞,而上皮来源的肿瘤细胞也并非都表达细胞角蛋白,特别是高转移性肿瘤在转移过程中往往有细胞角蛋白表达丢失的特性。因此,必须注意,细胞角蛋白作为检测指标有假阳性和假阴性的可能,用流式细胞术检测CTCs还有待于更特异的肿瘤指标的发现。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















