典型海洋生态系统,如珊瑚礁生态系统、红树林生态系统、海草生态系统、以及河口和海湾生态系统,在人类的干扰下均明显退化。
(一)珊瑚礁生态系统退化
珊瑚礁(图2-6)是分布于热带、亚热带的典型海洋生态系统。
全球海洋珊瑚礁有两个发育中心:一个在大西洋,它的中心是在加勒比海;另一个在印度洋-太平洋,它的中心是澳大利亚-东南亚海域,大体分布在赤道两侧南北纬30°之间的海域。迄今,已发现有珊瑚礁分布的国家和地区超过100个,覆盖面积约为284300km2(International Coral Reef Initiative(ICRI),2014)。

图2-6 珊瑚礁
珊瑚礁生态系统有着丰富的生物资源,其海洋生物物种的多样性可与热带雨林相当,也是天然药物资源的宝库,还是旅游、休闲胜地。此外,珊瑚礁可抗击风浪,对陆地和海岸起着保护作用。
然而,人类活动和全球气候变化,已对世界珊瑚礁产生了严重的威胁,珊瑚的覆盖率和生物多样性都发生了急剧的变化。琉球在进行港湾建设时掩埋了大大小小的珊瑚礁,使历经上万年形成的生机勃勃的珊瑚礁海域如今却形同荒漠。在马来西亚,由于棘冠海星(Acanthaster planci)的大量繁殖,导致珊瑚礁大量死亡。但人为的环境破坏和污染,要比棘冠海星的危害更大。丁加奴乐浪岛的珊瑚礁是世界上最大的珊瑚礁之一,但因受损严重,该珊瑚礁生态系统中的海洋生物难以生存(陈兰芝,2000)。
据《2008年世界珊瑚礁现状报告》,全世界范围内的珊瑚礁有54%处于退化状态,其中15%将在今后10~20年消失(特别是东南亚和加勒比海海域),另外20%可能在20~40年消失(《中国海洋发展报告》,2011)。
我国的珊瑚礁主要分布在南沙群岛、西沙群岛、东沙群岛,以及台湾、海南周边。少量不成礁的珊瑚分布在香港、广东、广西的沿岸,以及福建东山岛等地。
通常将珊瑚覆盖率超过50%以上视为珊瑚礁生态系统的健康标准之一。在20世纪80年代之前,西沙永兴岛、海南三亚湾、广东大亚湾的珊瑚覆盖率都在60%以上,但进入90年代后,除了永兴岛的珊瑚覆盖率依然可达较高的水平外,三亚湾、大亚湾的珊瑚覆盖率均急剧下降(图2-7和图2-8)。三亚鹿回头活珊瑚覆盖率在20世纪60年代达到80%左右,到90年代仅维持在40%左右,而到2006年进一步下降至12%左右。
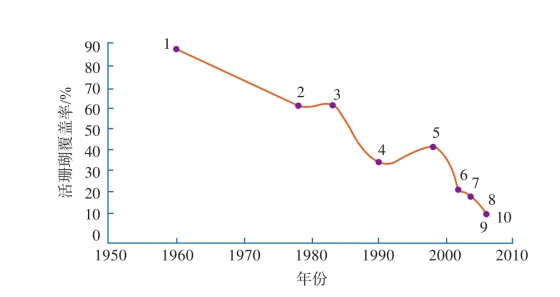
图2-7 三亚鹿回头珊瑚覆盖率变化趋势(引自赵美霞,2010)

图2-8 1993~1994年与2005~2006年三亚珊瑚礁多样性变化(引自赵美霞,2009)
(二)红树林生态系统退化
全世界红树植物种类有24科30属83种(或变种),有两个分布中心。一个是西方中心类群,主要以太平洋的斐济和汤加群岛为界,分布于热带美洲东西沿岸及西印度群岛,北可达佛罗里达半岛,南至巴西,经大西洋至非洲西岸,在中美洲西岸及加勒比海与南美北岸。西方中心共有种类14种。另一个是东方(旧大陆)中心,即以印度尼西亚的苏门答腊和马来半岛西岸为中心,其中可分为三支:一支从孟加拉湾—印度沿岸—斯里兰卡—阿拉伯半岛到非洲东岸,包括马尔加什;另一支是澳大利亚、新西兰沿岸;再一支是印度尼西亚各岛沿岸—菲律宾—中南半岛至中国。西太平洋由于受黑潮的影响,红树植物一直可分布到日本九州。东方中心共有种类72种。(孙鸿烈等,2005)
在我国,红树林(图2-9)自然分布于广东、广西、海南、福建和台湾。而秋茄(Kandelia candel)属于红树植物中的耐寒种类,在我国已逐步驯化北移至浙江省。

图2-9 红树林
由于人为的砍伐、干扰,在20世纪下半叶期间,世界红树林面积锐减,红树林资源迅速减少。据统计,1980年世界红树林面积约1880万公顷,但到2005年减少至1520万公顷,25年间减少了360万公顷(世界粮农组织,2007)。
红树林海岸减灾案例
实例一:1986年7月21日第9号强台风登陆,广西沿海海堤被冲垮80%,经济损失2.98亿元。幸存的海堤都是堤外红树林生长较好的海堤。例如,广西英罗港马鞍岭土筑海堤长1.8km,堤身几十年未修过,但因堤外有茂密的红树林的庇护,在9号强台风中只决口几处,损失少。相反,海堤外无红树林生长的地段,即使是石砌的岸堤也损失惨重。例如,合浦竹林盐场全长6~ 7km的海堤都是石砌海堤,堤底还有台阶,但在9号台风中崩溃缺口21处,其中崩溃缺口最长可达1.3km。
时隔10年,同样是在广西英罗港马鞍岭红树林区,一场有林存无林亡的强台风又为我们上了一堂悲壮的生态效益课。1996年9月9日10时40分,15号强台风卷起巨浪扑向在英罗港红树林内潮沟和林外200m余处裸滩停泊避风的400多艘渔船。停泊在林外裸滩的40余艘渔船中除2艘带锚向东南海区漂移1.5km而幸免于难外,其余的顷刻间在狂风巨浪中离散翻沉,遇难22人;而停泊于林内潮沟的350多艘渔船和船上的人员因有红树林的庇护全部安然无恙。
实例二:1985年第7号强台风袭击广东遂溪县西部海岸,风力11级,阵风12级。该县界炮、北潭两镇沿海的团结、斗佗、全帮、安塘、金围等6条堤围因有无红树林而出现不同的结果。堤外无红树林的团结围被冲垮了128m,红树林带宽不足10m的安塘围被冲垮了37m,其余4个堤围外因有40~ 160m宽红树林带的保护而未出现一处险情。广东廉江高桥镇的红寨海堤修建于1947年,围垦农田400余公顷。50多年来在无数次狂风恶浪的袭击中只出现过一个小缺口,从无险情出现,其根本原因是堤围外生长着大面积发育良好的红树林。
来源:吕彩霞,《中国红树林保护与合理利用规划》,海洋出版社,2002年。
我国南方各省,在20世纪七八十年代大量砍伐红树林,将红树林湿地开发成养殖塘、农田或进行基础设施,使红树林面积大大减少。1956年红树林面积为40000~42000hm2,1986年锐减为21283hm2,到90年代初仅剩下15122hm2。广东沿海,红树林在1956年、1986年和90年代初,其面积分别为21273hm2、3526hm2和3813hm2(李永祺等,2012)。
可喜的是,政府和当地老百姓逐渐认识到红树林在经济、社会、尤其是减灾方面的作用(见插文),自20世纪90年代起,通过建立国家和省级自然保护区(如海南东寨红树林国家级自然保护区、广东湛江红树林国家级自然保护区、广西山口红树林国家级自然保护区等),对红树林生长较集中的区域进行有效保护,并研究和进行红树的人工栽植等生态恢复工作,使我国红树林的面积得以逐年恢复。
(三) 河口和海湾生态系统退化
世界许多沿海国家,在历史上或至今都因人类的开发活动,致使海湾和河口生态系统的结构和功能受到明显的损害,如日本的水俣湾、美国的切萨比克湾和旧金山湾以及墨西哥湾等。旧金山湾,自18世纪中叶以来,随着人口增加和经济发展,在过去150年里,潮滩湿地减少了78%,注入该湾的淡水减少约1/2,水质受到严重污染。在1974~ 2001年间,该湾的苏珊湾,浮游生物量下降了约80%,大型浮游动物新糠虾(Neomysis spp.)几乎绝迹。
我国沿海的河口和海湾,近几十年来由于人为活动的影响,导致浮游植物、浮游动物和底栖生物的群落结构、多样性都发生了很大的变化。
1.长江口生态系统的变化
根据对1959年以来多次调查资料的比较分析,1959年至20世纪80年代,长江口水域浮游植物的种类主要为硅藻,其次是甲藻。但自20世纪90年代以来,浮游植物的群落结构发生了显著变化,突出表现在甲藻的种类和丰度显著增加,而硅藻的种类和丰度明显减小(图2-10和图2-11)。
国家海洋局海洋环境监测中心自三峡水库蓄水后连续5年的监测结果表明,长江口门以内水域浮游植物种类数从20世纪90年代初期的97种降至90年代末期的60余种,21世纪初降至51种,之后基本维持在30种左右。同时,甲藻所占浮游植物群落的比重由5%上升到25%(徐韧等,2008)。
同样,生活在长江口门以内水域的浮游动物种类数也有明显下降,从20世纪80年代的105种下降到90年代的76种,之后又进一步下降至30种左右(徐韧等,2008)。

图2-10 近50年来长江口海域浮游植物总种类数及硅藻、甲藻组成比例
(引自章飞燕,2009;转绘自丁兴平,2013)

图2-11 近50年来长江口海域硅藻、甲藻细胞丰度百分比
(引自章飞燕,2009;转绘自丁兴平,2013)
但长江口邻近海域,进入21世纪以来,由于中小型浮游动物种类和水母类的增加,浮游动物的种类数不仅没有降低,反而上升。
长江口附近海域,大型底栖动物的生物量、生物种数也发生了较大的变化。刘录三等(2008)认为,长江口底栖生物群落的变化大致可分为三个阶段:第一阶段是20世纪90年代以前,底栖生物群落无论是物种数、生物量都维持相对高的水平(稳定期);第二阶段发生在20世纪90年代初至2005年,底栖生物群落的上述指标均有所降低;第三阶段是2005年后,底栖生物群落得到一定程度恢复(缓慢恢复期)。
表2-3显示自1978年以来,长江口大型底栖动物的变化状况。
表2-3 长江口底栖生物种类组成的变化(引自丁平兴等,2013)

注: *括号内的数字表示种类组成比例(%);“—”为没有明确数据。
2.胶州湾生态系统的变化
胶州湾浮游植物群落,几十年来其结构发生了明显的变化,表现出网采浮游植物丰度下降、优势种类减少、赤潮发生频率增加等生态特征(表2-4)。
1977年2月~1978年1月,鉴定出胶州湾浮游动物共有116种,分为8门12纲27目64科66属,以后调查的浮游动物种数均少于此数(表2-5)。
最近几十年,胶州湾的大型底栖生物也发生了明显的变化。从1980年到1999年,其种类数呈逐年递减的趋势,合计共减少135种。其中减少最多的是多毛类,共减少77种;软体类次之,共减少55种;甲壳类减少了14种;棘皮类减少了6种。但进入21世纪后,大型底栖动物的种类数又有所回升(吴桑云等,2011年)。
表2-4 不同年代胶州湾浮游植物物种数目及优势种组成的变化(引自孙松等, 2012)

在20世纪80年代之前,胶州湾和青岛潮间带生物种类多种多样,是内地一些高等学校生物学专业教学的实习地点。后来,由于潮间带大都被围填,现已丧失了此功能。
表2-5 胶州湾浮游动物种数长期变化(引自吴桑云等,2011)

(四)海草生态系统退化
海草是唯一淹没在浅海水下的被子植物。海草与陆地植物一样,也有根茎叶的分化,也是通过光合作用获得自身生长所需能量的初级生产者。其花在水下结果,然后发芽(图2-12)。大多数海草外形十分相似,从匍匐的根茎向上生长。海草叶片柔软,长而薄,其间有气道,是单轴生长形式。海草的花着生于叶丛的基部,雄蕊(花药)和雌蕊(花柱和柱头)高出花瓣之上,花粉一般为念珠形且黏结成链状(图2-12)。
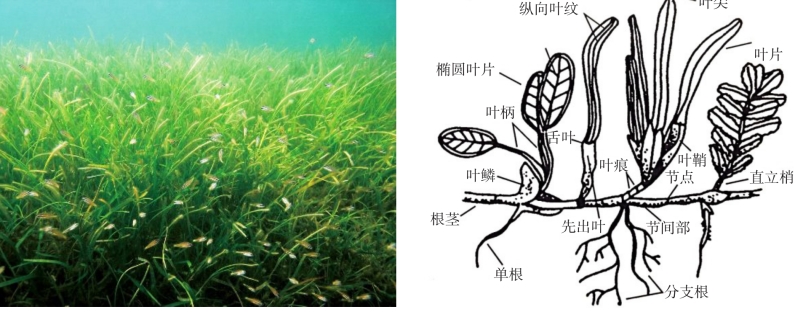
图2-12 海草床及海草形态结构(转绘自黄小平,2007)
海草在世界上大部分沿岸海域均有分布,最北在北纬70°30′的挪威Veranger海湾,最南在南纬54°的麦哲伦海峡。海草在世界沿海的分布有三个明显的中心,最大中心位于东南亚岛国地区,其余两个中心分别是日本、朝鲜半岛地区,以及澳大利亚西南部沿岸地区(黄小平,2007)。
海草能从潮间带向下扩展到60m深处,在潮下带长得最旺盛,呈稠密的地毯状分布,多者每平方米可达4000棵。和海洋中的其他初级生产者不同,海草是有根的植物。其他海藻的生产力取决于水中营养物质的浓度,而海草则主要从沉积物或基质中吸收营养物质。
与陆地上的草类有所不同,陆地上的草类被各种食草的动物(如牛、羊、兔等)大量吃食,但直接食用海草的海洋动物并不多,主要是海胆、海龟和少数鱼类。海草有很高的生态价值(见插文)。丰富的海草食物源进入浅海生态系统,主要是通过碎屑的途径(图2-13)。因此,海草床受到破坏,将直接和间接导致以海草为食物来源的生态系统受害。

图2-13 海草进入食物网的途径(引自尼贝肯,1991)
据报道,世界上已发现的海草可以分为5科13个属,一共60种。在我国,海菖蒲(Enhalus acoroides)、海黾草(Thalassia hemprichii)、喜盐草(Halophila ovalis)、海神草(Cymodocea rotundata)、二药藻(Halodule uninervis)和斜叶藻(Syringodium suitability)等是暖水性,分布于广东、海南和广西沿海;虾形藻属(Phyllospadix)和大叶藻(Zostera marina)是温水性,主要分布于辽宁、河北、山东等沿海;日本大叶藻(Zostera japonica)的分布可延伸到福建、台湾、广东和广西等沿海(陈永年,2004)。热带的海草种类数要比温带的多些。与淡水中的水生植物相比,海草的种类要少很多。
海草的生态价值
由海草构成的复杂生境为各种经济鱼类和甲壳类动物提供栖息场所、庇护场所、育仔场所。
海草床提高沿岸海域的生物多样性和生境多样性。
海草床通过降低水中悬浮物和吸收营养物质来改善水质。
海草光合作用释放出的氧气改善水质并供给其他生物群落。
制造有机物质。死亡的海草也是复杂食物链形成的基础,细菌分解海草腐殖质,为沙虫等动物提供食物。
通过营养物质的再生和循环,在全球碳循环中具有重要意义。
海草是浅海水域食物链的重要基础,直接食用海草的动物包括儒艮(Dugong dugon)、海胆、绿海龟(Chelonia mydas)、海马等。
海草生长于沿海海岸淤泥质或砂质沉积物上,可减弱海浪的冲击力,减少沙土流失,起到巩固海岸线的作用。
可用于盖海草房、编制席子、床垫等。
来源:黄小平,黄良民,2007年;略作修改
据资料统计,生长在全球12个国家或地区的海草资源日益恶化,有些地区海草已经绝迹,并危及到其他海洋生物的生存。全世界海草分布面积大约是177000km2,但自20世纪90年代以来,在10年内约有26000km2 的海草区消失,大约减少了15% (Green & Shrot, 2003)。
我国沿海海草床也受到严重损害。比如,山东威海市海岸浅海大叶藻原先十分茂盛,老百姓用大叶藻盖屋顶,冬暖夏凉,成为渔村的特色,但近20年海边很少能采到大叶藻。又如荣成市的天鹅湖,是个小海湾,20世纪70年代前,因湾内大叶藻长得好,有利于海参的生长繁殖,成为“参库”。80年代初,湾口被堵,影响湾内与湾外水交换,致使大叶藻大量死亡,以大叶藻为饵的海参也大量死亡。
在华南沿海,破坏海草资源的主要因素有两个方面:一是人类活动,二是台风引起的风暴潮、巨浪的破坏。损害海草床的人类活动主要有海水养殖、围网捕鱼、毒虾、电虾和炸鱼、采挖贝、耙螺、底网拖渔、人为污染,以及挖港池和疏浚航道等(黄小平,2007)。例如,广西合浦,在养殖范围的海域海草已绝迹,而在合浦的定洲沙、高沙头、英罗港一带10m以浅海域因拖网作业,将海草连根翻起,对海草造成严重破坏。而人工采挖沙虫、螺、蛤也常把海草连根翻起,使海草无法生存。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















