8.3.1 电子天平
电子天平属于精密、贵重仪器,用于称量试剂的质量。应置于室内干燥的平台或工作台上,并处于水平状态。在使用时应注意:
(1)使用天平前应仔细阅读使用说明书,熟悉天平的主要构件和操作面板,并根据所称量物品的质量和精度要求选择适当的电子天平。实验室现有的分析天平量程是200 g(精度0.001 g),120 g(精度0.0001 g)。使用时,所称质量(使用玻璃容器称取时,应包括容器质量在内)严禁超过量程,否则有可能损坏天平!
(2)天平使用前需要调水平,调节方式为:转动两个前支架直到气泡位于正中。
(3)对称量来说,只需使用电源开关键和去皮(Tare)键外,一般不要随意按动其他键。
(4)称量固体试剂时,应选用合适大小的称量纸,去皮(Tare)后再用药匙取适量试剂(宁少勿多!)轻轻撒在称量纸上(切不可用力过猛,更不能用试剂瓶直接倾倒!),操作时应小心,避免药品撒到仪器或桌面上(可以把称量纸边缘折成盘状)。在临近称量值时,要轻轻抖落,以免多加。
(5)在称量强吸水性物质、腐蚀性物质(如三氯乙酸、氢氧化钠固体)时,不能使用称量纸,而要用玻璃器皿(如锥形瓶、培养皿、称量瓶等)。此时,应注意包括容器在内的总质量不得超过天平的量程。还应注意:称量过程要尽可能快。防止试剂吸水造成的称量误差。
(6)称量液态物质时,要用玻璃器皿(如锥形瓶、培养皿、称量瓶等)。要用滴管或移液枪将所称取的液体加入称量容器,严禁用试剂瓶直接倾倒。此时,应注意包括容器在内的总质量不得超过天平的量程。
(7)依次称取多种试剂时,应称量一种,打开一瓶,并在称量后立即盖上瓶盖,然后再称取另一种试剂。切忌同时打开多个试剂瓶,用后将瓶盖“张冠李戴”。
(8)天平使用完毕后,要尽快清理干净。清理时,应用毛刷轻轻刷除遗留的药品粉末,以防腐蚀。离开时关闭电源,拉上玻璃拉门。
8.3.2 移液枪(微量移液器)
微量移液器是一种在一定容量范围内可随意调节的精密取液装置(俗称移液枪),基本原理是依靠装置内由调节轮控制螺杆上下移动,推动按钮带动推动杆使活塞向下移动,排除活塞腔内的气体。松手后,活塞在复位弹簧的作用下恢复原位,从而完成一次吸液过程。移液枪属于精密仪器,应严格按照要求小心使用和放置,严禁猛烈碰撞或摔击等。在使用时,也要注意正确吸液、排液和放置,以做到准确吸量和不损坏移液枪。
(1)实验室配有1000 μL、200 μL、20 μL、10 μL和2.5 μL五个量程(即最大取样体积)的常用移液枪(如图8-1所示),使用前应注意查看枪的量程值(如图8-2所示),根据需要量取的体积选用适当的移液枪。并装配相应大小的枪头(吸液嘴)(如图8-3所示)。对单道移液器装配枪头时,应将移液端垂直插入吸头,左右微微转动,上紧即可(如图8-4所示);对多道移液器装配枪头时,应将移液器的第一道对准第一个吸头,倾斜插入,前后稍许摇动上紧,吸头插入后略超过O形环即可,并可以看到连接部分形成清晰的密封圈。严禁用移液器反复撞击吸头来上紧枪头,这样会导致移液器部件因强烈撞击而松散,严重时会导致调节刻度的旋钮卡 住。
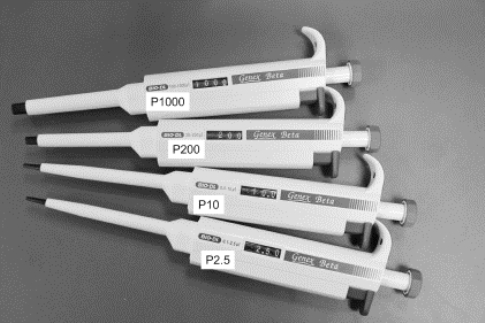
图8-1 实验室使用的不同量程移液枪

图8-2 移液枪的结构
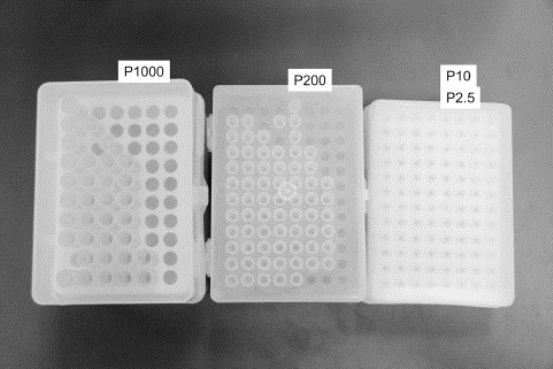
图8-3 不同量程移液枪适配的枪头
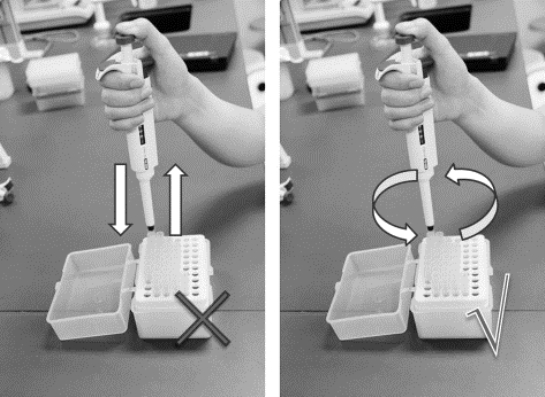
图8-4 移液器端正确插入吸头
(2)使用时,移液前,应使移液器、枪头和液体处于相同温度(如灭菌后的枪头需冷却后使用)。还应检查移液枪是否有漏液现象。检查方法是:吸液后竖直停留1~3秒,观察吸头内液面是否下降。漏液的原因大致有:①枪头不匹配,应更换枪头;②弹簧活塞不正常,应交教师处理;③如果是易挥发性液体(许多有机溶剂都如此),则可能是饱和蒸汽压的问题。可以先吸放几次液体,然后再移 液。
(3)吸量前,应首先转动调节刻度旋钮,调节显示刻度至所需吸量体积。调节时,必须注意:①严禁单次取样超过仪器量程(使显示取样体积超出量程),否则会损坏移液枪;②从大体积调节到小体积时,逆时针旋转刻度即可;③从小体积调节至大体积时,可先顺时针调至超过设定体积的刻度,再回调至设定体积,这样可以排出多余空气,保证最佳的精确度(如图8-5所示)。

图8-5 转动调节刻度旋钮
(4)吸量时,应右手持枪,拇指位于移液枪吸/排液按钮处,其余四指握住移液枪,注意枪的方向(如图8-6所示)。吸取液体时,移液器应保持竖直状态。一般采取“前进移液法”:用拇指将按钮按下至一挡,然后将枪头插入液面下2~3mm,缓慢松开按钮回原点以吸取液体,完成吸液,否则液体进入吸头过快会导致液体倒吸入移液器内部,使吸入体积减少,还有可能损坏仪器。排液时,将枪头对准所用容器,贴壁并保持一定角度,将按钮按至第一停点,稍停1秒后继续按按钮至二挡,将剩余液体全部压出,完成排液。然后缓慢松开按钮。在用于转移高黏性液体、生物活性液体、易起泡液体或极微量的液体时,还可以采用“反向移液法”。就是先吸入多于设置量程的液体,转移液体时不用吹出残余的液体。先按下按钮至二挡,慢慢松开按钮至原点。接着将按钮按至第一停点排出设置好量程的液体,继续保持按住按钮位于一挡(千万别再往下按),取下有残留液体的枪头,弃之。无论采用哪种方法,在吸液和排液时,均要保持移液枪垂直,并慢吸慢放。在吸液之前,可以先吸放几次液体以润湿吸液嘴(尤其是要吸取黏稠或密度与水不同的液体时)。

图8-6 移液枪吸/排液按钮
(5)移液枪使用后,应规范放置。即:将移液器量程调至最大值,且将移液器垂直放置在移液器架上,但要小心别掉下来。当移液器吸嘴中有液体时切勿将移液器水平或倒置放置,以免液体流入活塞室腐蚀移液器活塞弹簧。
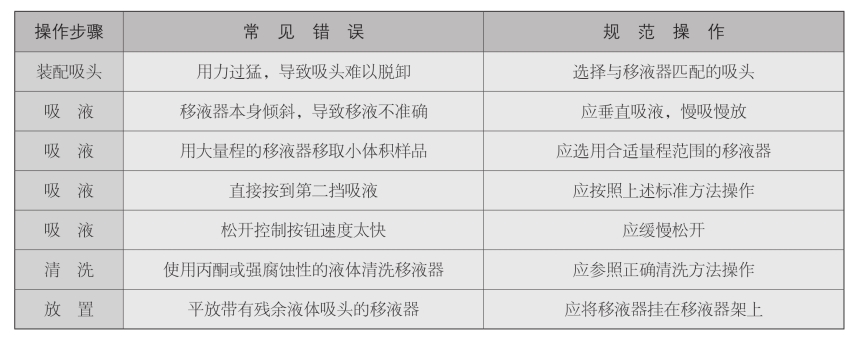
移液枪使用中常见错误与规范操作的比较如表8-1所示。
表8-1 移液枪使用中常见错误与规范操作的比较
8.3.3 离心机
离心机是用于分离的必备仪器。属于精密仪器。仪器应置于室内干燥的平台或工作台上,并处于水平状态,在电源线路中安装插座和漏电保护开关,并安装接地。使用时必须按照操作规程进行,否者极易损坏仪器,同时,还会造成人身伤害。
(1)选择合适转子 离心机按照转速可分为低速(最高转速4000 rpm)、高速(最高转速12000~20000 rpm)和超速离心机(转速30000 rpm以上)。离心机的主要部件包括电机、主轴、转子、内盖和外盖。高速和超速离心机在使用时需要选择合适的转子。转子按照离心时的运行角度可分为角度头、水平转子等;按照装载容器可分为提篮式、单管式和排管式。单管式往往采用角度头转子,提篮式和排管式往往采用水平转子。在使用时,如果使用离心管,一般应选用单管式转子。在选择转子时,应特别注意转子允许的最大离心力(g)、最大转速等指标。
(2)检查仪器和离心管(或其他容器) 在离心开始前,必须认真检查仪器和离心管(或其他容器)是否正常。检查内容包括:仪器部件是否齐全、电路部分是否正常工作、显示面板是否正常显示、转子和仓体是否干燥、离心管是否完整无裂痕、不泄漏等。如果电路不正常,可能造成仪器损坏和人员伤害,后果非常严重!如果离心管或其他容器在离心过程中破裂,可能造成仪器损坏和人员伤害,后果非常严重!
(3)离心管的平衡 在使用时,必须在托盘天平上认真对离心管进行平衡,不得用目测液体多少代替平衡。如果离心机配有套管,应该将套管和装有待离心溶液的离心管一起平衡,平衡后不得随意更换套管。如确有必要更换套管或离心管,必须重新平衡。平衡后的离心管应注意对称装入离心机。如果离心管不平衡,可能造成仪器损坏和人员伤害,后果非常严重!
(4)安装内盖 高速和超速离心机一般都配有内盖。全部离心管装入后,必须在转子转轴上安装内盖并旋紧。旋紧时,不能过度用力,或螺口不对齐,否则可能会损伤转子和机盖。如果不安装内盖或没有旋紧内盖,可能造成仪器损坏和人员伤害,后果非常严重!
(5)盖上外盖 中高端的高速离心机的外盖一般带有自锁装置。在不通电的情况下是打不开的。低端的台式离心机一般带有手动锁,需要按动按钮打开。但锁上时,只要将外盖按下即可,不要过分用力。
(6)开机 离心机接通电源之前,必须将离心机的转速设置为0。开机后,按照说明书的要求设定转速、离心时间、温度要求等参数,然后逐渐升高转速,不可直接将转速提高到所需转速(不同离心机、不同转速、不同转子的提速时间不同)。对于全自动离心机,则不需要手动调节转速。
(7)离心结束 离心结束后必须等离心机完全停止转动后方可打开外盖(全自动离心机自带安全设置,在停止转动前无法打开外盖)。然后打开内盖,缓缓取出离心管(切忌振荡!)。
(8)关机 对低温离心机,如果其他人员在短时间内还需要使用离心机,不必关闭电源,以防止制冷设备反复启动。全部人员使用完毕后,应关闭离心机。关机前,必须将转速设置为0(全自动离心机可不做此项设置)。必须认真清理离心机。如有腐蚀性化学品(强酸、强碱、汞离子溶液、铜和其他金属离子、氯化物、浓盐和苯酚等)污染了舱体、转子、套管等部件时,必须在教师的指导下认真清理。如果在离心时使用了制冷程序,不宜马上关闭离心机盖,必须等其干燥之后再关闭,以免产生冷凝水锈蚀仪器。
(9)其他注意事项
最大转速下,离心的物质密度不能超过1.2 g/mL。
使用过有机溶剂(苯酚、氯仿等)的离心管应注意其是否老化。
在装转子前,清洁马达选轴和转子插孔,对转子密封圈、马达转轴经常使用润滑油。
8.3.4 超净工作台
超净工作台是无菌操作的专用设备。禁止挪作他用。
(1)按键ON/OFF为仪器总开关,一般位于仪器右侧下部。使用前30分钟,按下按键使其在“ON”的位置,然后打开操作面板上的“照明/杀菌”开关和风机组开关,同时开启紫外灯和风机组,30分钟后关闭紫外灯。注意:紫外灯开启时,应远离超净工作台,切勿进行操作或直视紫外灯,否则会对皮肤和眼睛造成严重伤害!
(2)关闭紫外灯后,用75%酒精棉花擦拭,将紫外灯表面和工作台内表面擦干净,保证其灭菌效率。但不能用酒精等有机溶剂擦拭有机玻璃挡 板。
(3)工作台面上禁止存放不必要的物品,以保持工作区的洁净气流不受干扰。
(4)禁止在工作台面上记录书写,工作时应尽量避免做明显扰动气流的动作。
(5)当需要调节风机风速时,用工作台操作面板上的轻触型开关进行调节。风机调速指示由屏幕数字显示。
(5)使用完毕后应及时按OFF关机,延长过滤网使用寿命。还应该在教师指导下定期清理过滤网,以保证灭菌效 率。
8.3.5 LDZX型立式压力蒸汽灭菌器
压力蒸汽灭菌器(如图8-7所示)是对小工具、器皿、培养基湿热灭菌的专用仪器,不可挪作他用。仪器应置于室内干燥的平台或工作台上,并处于水平状态,在电源线路中安装插座和漏电保护开关,并安装接地。立式压力蒸汽灭菌器属于大功率用电器,必须使用单独插座,不可使用拖线板。使用前应认真检查灭菌器的电路是否正常、锅盖上的安全阀和放气阀是否正常、下部的放水阀门等是否正常、锅内水位是否合适。水太少时,高压锅干烧,可能发生爆炸等严重后果。水太多时,可能引起倒灌。

图8-7 LDZX型立式压力蒸汽灭菌器外观
(1)开盖 开盖前必须确认压力表指针归零,灭菌器内无压力。开盖时,逆时针方向将四个紧固螺杆旋松放下,提起盖把手,使锅盖向上翻开,开启锅盖。
(2)通电 将控制面板上的电源开关按至ON处,控制面板上的电源灯(红灯)亮,显示电源已正常输入本机。水位灯灭,灭菌器内属于断水状态,压力表指针归向零位。
(3)加水 将蒸馏水直接注入灭菌器内,同时观察控制面板上的水位灯,水位灯灭时,应继续添加,至水位灯亮(每次使用前均需补充上述水位)。当加水过多溢至内胆中时,应开启下排水阀放掉内胆中多余的水。本型号需水量约为8 L。
(4)堆放 将包扎好的待灭菌物品,依次堆放在灭菌筐内。堆放时不能太满,还必须注意各包之间留有空隙,并留出安全阀和排气孔空隙,严禁堵塞安全阀和排气阀出气孔,否则可能造成安全阀气孔堵塞,造成锅体爆炸事故。如对液体(如培养基、缓冲液等)进行灭菌时,必须注意液体体积不得超过容器的一半;如容器有密封功能(如磨口瓶、具有塑胶垫圈的离心管等)时,应注意盖子与瓶口或管口之间必须留出间隙,不可封死。否则,可能会造成容器炸裂!
(5)密封 将锅盖的缺口对准四个螺杆放下,将螺杆全部嵌入锅盖缺口,顺时针方向将四个紧固螺杆拧紧,拧紧时对角同时进行,加力使之充分密合。
(6)温度与时间设定 将温度旋钮向左转调至所需灭菌温度位置即可,温度控制器采用压控开关,精确温度选择应对照压力表指针位置进行温度旋钮选位矫正。本灭菌器温度选择范围为116 ℃~127 ℃;将定时器旋钮向右转调至所需的灭菌时间位置即可,定时器采用倒计时方式,当锅内达到所选择的灭菌温度后,定时器才开始工作,计算所需要的灭菌时间。本灭菌器时间的选择范围为0~60分钟(如图8-8所示)。

图8-8 LDZX型立式压力蒸汽灭菌器控制面板
(7)灭菌 温度时间设定完毕,控制面板上的工作灯亮,灭菌器正常加热升温(升压)。当灭菌室内达到设定温度时,工作灯会间断,进入灭菌倒计时。注意:如在灭菌过程中安全阀跳起应立即关闭电源!
(8)关机 灭菌完成,自动关闭加热系统,此时,应将电源开关按至OFF;关闭电源。注意:严禁在关闭电源后马上打开放气阀或开启锅盖!
(9)启盖 压力表指针归零后,先开启安全阀排放灭菌器内余气,然后沿逆时针方向将四个紧固螺杆旋松放下,提起盖把手,使锅盖向上翻开。注意:必须待压力表归零,并开启安全阀排放灭菌器内余气后方可开盖,否则开盖时蒸汽喷出可能会造成严重烫伤!
(10)取出灭菌物品 开盖后,依次取出锅内物品,并有序摆放。不得长时间储放在锅内。注意:此时锅内温度仍然较高。取物时应佩戴棉布手套,注意防护,避免烫伤!切忌佩戴乳胶手套或塑料膜手套拿取物品。
(11)其他注意事项
●使用玻璃容器放置灭菌液体时,应选用耐热的玻璃容器。并用棉塞、锡箔纸、牛皮纸等封闭瓶口,切勿使用未打孔的橡胶或软木塞。
●切勿将不同类型、不同灭菌要求的物品(如敷料和液体等)一起灭菌。
●对塑料管等物品进行灭菌前,应确认该种塑料可以进行高温高压灭菌,否则会造成塑料器具严重变形,无法使用。
●若压力表指针已回复零位,而盖不易开启时,可将放气阀置于放气位置一段时间,使外界空气进入灭菌器内,真空消除后,盖即可开启。
●灭菌器必须使用医用蒸馏水。
●灭菌器清洗应一月一次,清洗时,将内胆取下,用毛刷将附在内壁上的水垢刷去,再用干净布擦拭干净即可。平时应使灭菌器保持清洁和干燥。如发现橡胶圈使用日久老化,应立即更换。如发现仪器有任何异常(如压力指示不正确或不能回复零位),应立即停止使用,马上检修。
●如果有的物品灭菌后需要迅速干燥,须打开安全阀或将排气排水阀向左旋至“开”位置,让灭菌器内的蒸汽迅速排出,使物品残留水蒸气快速挥发。注意:灭菌液体严禁使用此方法!否则可能造成爆炸等严重后果;放气时,操作者必须注意防护,不能使自己处于气体喷出的位置,否则可能造成烫伤!
●本仪器是全自动控制的,但也必须随时注意仪器的运行情况,不得在灭菌过程中擅自离开。
8.3.6 干燥箱
干燥箱是对物品进行干燥处理的专用设备,分为真空干燥箱和干热干燥箱。注意:干热干燥箱与生化培养箱外观相似,但可控温度范围相差很大,最高温度可达200 ℃,切忌误用!否则可能引发火灾!
(1)在使用前,必须确定待干燥的物品可以使用干燥箱处理。一般来说,只有金属类、玻璃器皿才能使用干燥箱。注意:严禁将纸张、棉制品、塑料制品、装有液体的容器等装入干燥箱处理,否则可能引发火灾!
(2)使用时,接通电源后即可开启加热开关。将干燥箱温度设定拨盘拨至所需的工作温度值即可。对于数字化控制的干燥箱,则将温度“设定—测量”开关置于“设定”,调节温度设定旋钮至所需工作温度后,将“设定—测量”开关置于“测量”,此时箱内开始升温,绿灯亮起。注意:即使是自动控制的干燥箱,也必须随时注意仪器的运行情况,不得在运行过程中擅自离开。以免仪器失灵造成温度失控,引发火灾。
(3)使用完毕后,拿取物品时应佩戴棉质手套,切忌佩戴乳胶手套或塑料膜手套拿取物品。以免烫伤。
8.3.7 生化培养箱
生化培养箱是进行微生物等进行恒温培养的专用设备,分为水热式、电热式和干热干燥箱。注意:生化培养箱与干热干燥箱外观相似,但可控温度范围相差很大,最高温度不得超过65 ℃,切忌误用!否则可能引发火灾!
(1)接通电源 打开电源开关,使开关处于“通”的位置,设备即进入通电状态。此时即可开始温度和时间的设定操作。
(2)LRH-150生化培养箱的温度与时间设置 按动温度/时间键可进行温度与时间切换。
●温度设定:按一下温度/时间键,仪表的温度设定指示灯亮。按设定键进入SV状态,设定显示窗三个数字中有一个数闪烁,再按移位键(<)将闪烁数位移至需设定位,然后按∨或∧键即可改变温度设定值至所需温度(最小值0 ℃),最后按下设定键将设定值存入单片机,此时左显示窗显示测量温度,右显示窗口显示设定温 度。
●时间设定:按一下温度/时间键,仪表的时间设定指示灯亮。按设定键进入TV状态,设定显示窗三个数字中有一个数闪烁,再按移位键(<)将闪烁数位移至需设定位,然后按∨或∧键即可改变时间设定值,直到所需时间(最小值1小时),最后按下设定键将设定值存入单片机,此时左显示窗显示测量时间,右显示窗显示设定时间。
●定时功能:仪器送电时,定时功能开始启动。定时结束后,输出关闭。加热器和制冷压缩机停止工作,培养箱内温度将逐渐达到外界环境温 度。
●状态指示:设定完成后设备按设定好的参数运行。当测量温度低于设定温度时,设备进入加热状态,加热指示灯亮。反之,当测量温度高于设定温度时,制冷指示灯亮,设备进入制冷状态。当测量温度高于设定温度4 ℃时,报警指示灯亮,蜂鸣器也发出鸣叫 声。
●参数修改:运行中若要修改温度、时间参数,再按程序1、2进行修改。
●快速设定:在设定参数时,三个数字中有一个数闪烁,若按∧键则设定值末位数加1;若按此键不放开,约3秒钟后,设定值连续加1;若按∨键,则设定值减1;若按住该键不松开,约3秒钟后,设定值连续减1。
(3)培养 培养过程中,应随时保持箱门关闭,尤其是使用制冷功能时更应如此。培养完毕后,应将培养物及时取出,不得长时间放置在培养箱内,以免发生污染。
(4)生化培养箱使用与维护的其他注意事项
●培养箱在搬运中,禁止倒置及大于45度的平放。
●使用中切勿频繁改变设定值,以免压缩机频繁启动造成过载,影响设备使用寿命。
●箱内不需照明时,应将照明开关置于“关”位置,以免影响上层温度,同时延长灯管使用寿命。
●本机装有二组保险丝,运行中若发生故障,请先切断电源,检查保险丝是否完好,再检查其他部位。
●为了保持设备的外观,切勿用腐蚀溶液擦拭外表,箱内可用干布擦拭,保持箱内清洁。如果发现箱内有污染,应及时清除。但不能用腐蚀性较强的液体(如高浓度84消毒液)清洁。
●当设备不用时,应切断电源,并保持箱内干燥。
●为确保箱内温度均匀,应经常检查箱内轴流风机是否正常运行。实验时,箱内物品不宜摆放太密且切勿阻挡风机出风口,以利于箱内气流循 环。
●切勿触摸、碰撞箱内感温探头,以免造成温度失控。
●设备发生故障,应请专业人员维修或与销售联系,用户请勿任意拆修。
8.3.8 摇床(恒温振荡培养箱)
摇床是对微生物、细胞悬浮液等进行恒温振荡培养的专用设备。禁止用于其他用途。应置于室内,并处于水平状态,在电源线路中安装插座和漏电保护开关,并安装接地。
(1)使用前,应检查仪器的电路是否正常、转速设置是否归零、是否有异物留在箱体内、固定培养瓶或试管的装置是否完好等。
(2)在放入培养瓶或试管时,应固定好,防止振荡过程中脱落。注意:一旦试管或培养瓶脱落或仪器内有异物,不但会造成振荡培养失败,而且容易卡住仪器的转动部分,导致电机烧毁,严重时会引发火灾!
(3)开机:按侧面电源开关完成开机,运行键指示灯亮开始运行。
(4)温度设置:按温度图标,显示在设定温度和实际温度之间切换。设定温度时,按设置键(方块图标),显示0,用上下箭头调到3,再按一次设置键显示设置温度,用上下箭头调到合适值,按设置键确认。
(5)转速设置:按转速图标,显示在设定转速和实际转速之间切换。注意:开机前转速应置于“0”的位置。设定转速时,按设置键,显示0,用上下箭头调至3,再按一次设置键,按转速图标(环形箭头),显示原先所设值,按用上下箭头调至合适值,按设置键确认。
(6)定时设置:此项一般不用修改,默认设为机器长期运行。
(7)模式设定:当设定温度与环境温度之间的温差不同时需要设定不同控温模式,具体操作见说明书。
(8)关机:按运行键(太阳图标)指示灯灭,按侧面总开关完成关机。
(9)其他:摇床转动/暂停键为斜箭头图标,用于放样品时暂停摇动(放好后勿忘恢复摇动)。仪器侧面有照明开关,方便观察。如要使用其余功能先阅读详细说明书。
8.3.9 水浴锅和恒温水浴槽
水浴锅和恒温水浴槽是进行水浴保温的专用仪器。应置于室内干燥的平台或工作台上,并处于水平状态,在电源线路中安装插座和漏电保护开关,并安装接地。
A.恒温水浴槽操作如下:
(1)将蒸馏水从工作室上部注入,切记:水位不得低于工作室内的隔板。
(2)接通电源,打开电源开关,指示灯亮,表示电源工作正常。此时,仪表上排显示工作室温度,下排显示设定温度。
(3)温度设置:按动SET键,使上排显示50,按上下设定所需温度,再按SET保存设定值。
(4)保温时间设置:按SET键10秒,出现第二菜单。下排设定时间分钟,测量温度达到设定的时间后,下排显示熄灭输出功能停止,如果要恢复设定控制时间应先关机再通电开机。设定为0时仪表取消定时功能,连续输 出。
(5)其他:仪表自整定功能,按下键5秒自整定结束后AT灯灭,得出一组能克服超温的PID参数。在自整定过程中按下键5秒后AT灯灭,自整定停止,仪表按原来的PID参数进行控制。
B.水浴锅操作如下:
水浴锅的设置较为简单。接通电源后,仪表显示工作室温度。将控制仪表旋钮或拨码开关调节到所需要的温度,工作室内开始加热,控温仪表上绿灯亮表示通电升温,红灯亮表示断电保温,红绿灯交替变化表示进入恒温状态,当仪器恒温30分钟后仪表显示和设定温度基本一致,即可使用。
C.水浴锅和恒温水浴槽的操作均应注意:
●本仪器外壳必须可靠接地,以防止漏电,保证安全使用。
●水温达到所需温度并恒定后,方可放入待保温物品,开始计时。
●仪器应放置在具有良好通风条件的室内,室内相对湿度不大于85%,其周围不要放置易燃易爆及腐蚀性物品。
●要经常检查工作室内的水位,不能缺水,更不能无水干烧,以免损坏加热管。注水不可将水流入或溢入电器控制箱内以防发生危险,不用时及时把水放掉,并将箱内擦干净,保持清洁。
●控制系统没有专业设备和技术人员不能随意调动及拆卸机内元器件,以免影响控温精度,缩短使用寿命。
8.3.10 杭州博日BIOAIR GeneQ基因扩增仪TC-24/H(B)

图8-9 PCR仪外观
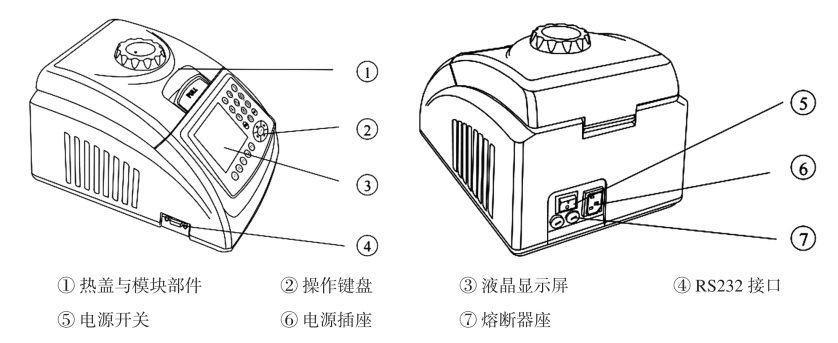
图8-10 PCR仪结构示意图
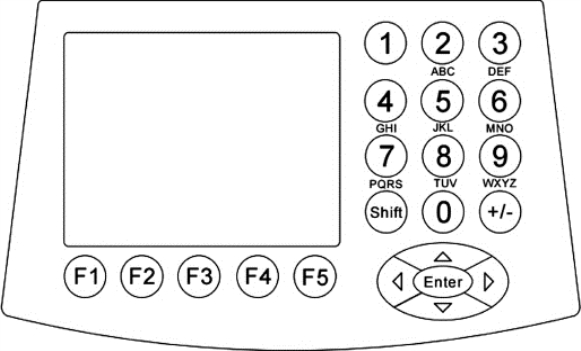
图8-11 PCR仪键盘示意图

图8-12 PCR按键示意图
PCR仪(如图8-9,图8-10,图8-11,图8-12所示)是用于DNA扩增的专用仪器。应置于室内干燥的平台或工作台上,并处于水平状态。禁止挪作他用。操作步骤如下:
(1)开机前检查
在插上插头将仪器通电以前,应先确认以下内容:
●电源是否与仪器要求的电压相符合;
●确认电源线插头已可靠插入电源插座中;
●电源线接地可靠。
(2)开机
●打开电源开关(将开关拨至“—”的位置),扩增仪会发出“嘟”“嘟”两声,表明电源已接通。
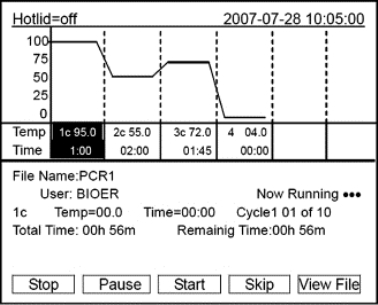
●此时屏幕将显示“Self testing……”,仪器将进行自检。自检需要1~2分钟,请耐心等候。若自检没有发现问题屏幕将出现主界面(如图8-13所示),以下就可以进行PCR扩展文件的编辑、查阅、修改和删除等操作。
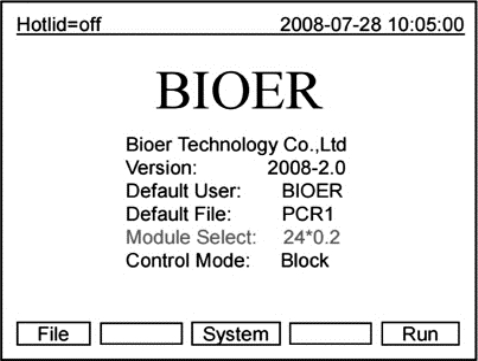
图8-13 PCR仪开机后的主界面
(3)运行PCR程序
●主界面(如图8-13所示)左上方显示的是热盖设置状态。主界面中间显示的是博日公司信息、软件版本号、模块类型、默认程序、默认使用者、控制模式和样本量等信息。
●按“File”键进入文件列表界面。
●按“System”键进入系统参数设置界面。
●如果当前默认文件不带有密码,按“Run”进入运行模式或样本容量输入窗口;如果当前默认文件带有密码,按“Run”键弹出输入密码对话框。

在本界面中按数字键即可输入密码。按“Back”键返回主界面。按“Accept”键确认密码,进入文件运行界面或样本容量输入窗口。如果密码输入错误,将弹出以下提示对话框:
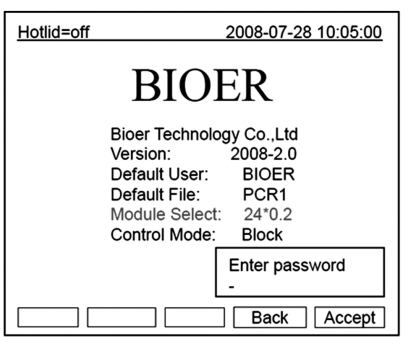

如果当前Controlmode为Block模式,按“Accept”键进入文件运行界面。如果当前Controlmode为Tube模式,按“Accept”键弹出样本容量输入对话框。


在本界面中按字符键即可根据实际情况输入样本容量。在Tube模式控温下,不同的样本容量将有不同的过冲温度及持续时间。
按“Back”键返回主界面。
按“Run”键进入文件运行界面。
(4)编辑PCR程序
在主界面中按“File”键进入文件列表界面,如右图文件列表中有3份文件,当闪烁条在User栏闪烁时,可通过方向上下键选择用户,同时File Name栏会动态显示选定的用户对应的文件;通过右键切换至File Name,此时,闪烁条在File Name栏闪烁,通过上下键选择对应用户的文件。
●按“New File”键可编辑一个新文件。
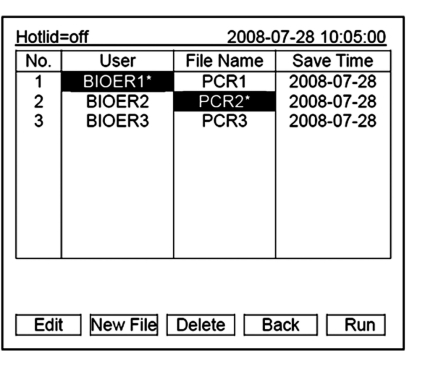
●按“Delete”键将提示“Do you want to delete the file? Please select‘F3’or‘F4’”,按提示信息选择删除(Delete)或(Back)。
●按“Back”键返回主界面。
●如果文件未设置密码,按“Edit”键进入文件编辑界面;如果文件设置有密码,按“Edit”键弹出输入密码对话框。

在本界面按数字键直接输入密码,按“Back”键返回文件列表界面。按“Accept”键确认密码,进入文件编辑界 面。
●如果文件没有设置密码,按“Run”键进入文件运行界面或样本容量输入界面;如果文件设置有密码,按“Run”弹出输入密码对话框。在输入密码对话框中输入正确密码,按“Back”键返回文件列表界面,按“Accept”键确认密码,进入文件运行界面或样本容量输入窗 口。
●在文件列表界面按“Run”键输入文件密码后:
如果当前Controlmode为Block模式,按“Accept”进入文件运行界面;如果当前Controlmode为Tube模式,按“Accept”键会弹出样本容量输入对话框:

和主界面相同按数字键,可根据实际情况输入样本容量,按“Back”键返回到文件列表界面;按“Run”进入文件运行界面。
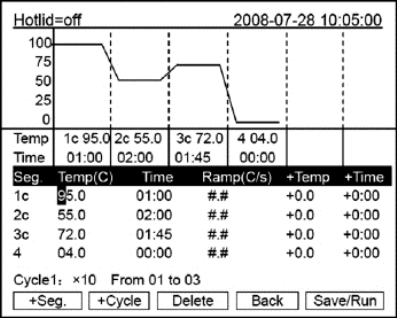
注意:用户和文件的右上角显示“*”,表示此文件为系统默认的运行文件,默认运行。文件可在系统参数设置界面中修改。●在本界面可编辑文件的节和段,文件由节和段构成,段中包含有节,段内的节可设置循环次数(如图8-14所示)。按光标上下移动键、光标左右移动键移动光标,光标所在之处文字颜色反白显示。按字符键可改变参数设置。按正负键改变正负 号。
按“+Seg.”键进入节编辑状态。在一节中,可依次设置温度(Temp)、持续时间(Time)、升降温速率(Ramp)、每循环温度增量(+Time)。按“Delete”键将立即删除光标所在一节。按“+Cycle”键记入段编辑状态。可依次设置循环数和循环起始节。如下图所示的设置表示在第一段中从第1节到第3节循环,共循环10遍。重复按“+Cycle”键可添加段(最多5个段),按“Delete”键将立即删除当前段。按光标上下移动键可分别进入前一段或后一段。按“Save/Run”键进入文件保存界面。按“Back”键退回到文件列表界 面。
特别提醒:① 新编辑的PCR程序请先保存再运行,否则文件运行结束后不保存程序文件;
②“Time”设置为“—:—”时,将在模块控温的同时自动关闭热盖。
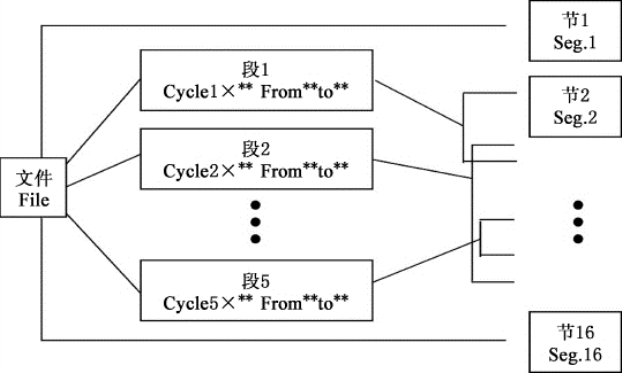
图8-14 文件中节和段的关系图
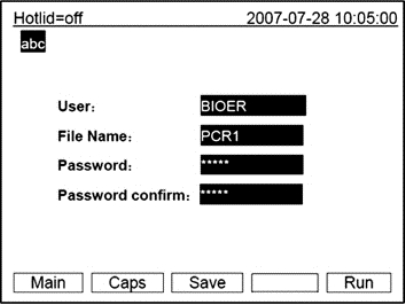
●在本界面中按字符键即可输入文件名,按确认键光标后移一位。用上下键选择User、File Name、Password或Password confirm。左键删除字符,右键移动光标。按Caps键可改变输入字符的大小写,在屏幕左上角处有大小写提示(如下图中 )。
)。
按“Main”键退回主界面。按“Save”键可保存该文件。文件正常保存后,系统将提示“File have been saved.Please continue another operation”,按确认键提示条消失。如果文件重名,系统将提示重命名(Rename)或继续保存(Save)。如果当前Controlmode为Block模式,按“Run”键进入文件运行界面;如果当前Controlmode为Tube模式,按“Run”键会弹出样本容量输入对话框。

●和主界面相同,可根据实际情况输入样本容量。按“Back”键返回文件保存界面;按“Run”键进入文件运行界面。
●进入文件保存界面,如果未按“Save”键,直接按“Run”,系统将提示“Themodifications will be lost after running.Do you still want to run?”按“No”返回文件保存界面。按“Yes”进入文件运行界面及样本容量输入界面(注意:此次修改程序运行完成后将不会保存)。按“Yes”后,如果当前Controlmode为Block模式,程序进入文件运行界面;如果当前Controlmode为Tube模式,弹出样本容量输入对话框:


●和主界面相同,可根据实际情况输入样本容量。按“Back”键返回文件保存界面;按“Run”键进入文件运行界面。进入文件运行界面后,文件正常运行时,Now Running处的“...”会不断闪烁。运行结束后,系统将提示“File running is over,Press‘Enter’back to themain interface.”按“Stop”键将提示“Do you want to stop running?Please select‘F1’or‘F3’.”,按提示信息选择停止(Stop)或继续(Start)。按“Pause”键将提示“Pause state now.Press‘F3’to continue running.”,按提示信息选择继续(Start)。按“View File”键可查看已编辑的PCR程序。按“Skip”键可直接跳过目前的温度段进入下一个温 度。
8.3.11 电泳仪和琼脂糖凝胶电泳槽
电泳仪是为电泳槽提供稳定、可控直流电源的专用仪器,不得挪作他用。电泳槽可分为垂直和水平两大类,琼脂糖凝胶电泳槽属于水平电泳槽。
琼脂糖凝胶电泳是用琼脂糖作为支持介质的一种电泳方法,孔径较大。一般可用于分离相对分子质量较大的样品,如大分子核酸、病毒等。
琼脂糖凝胶电泳最高分辨率可区分相差100 bp的DNA片段,其分辨率虽比聚丙烯酰胺凝胶低,但制备容易,分离范围广,尤其适于分离大片段DNA。普通琼脂糖凝胶分离DNA的范围为0.2~20 kb,利用脉冲电泳,可分离高达10~7 bp的DNA片段。
特别提醒:电泳仪和琼脂糖凝胶电泳槽在使用过程中有可能受到EB污染,必须在指定位置使用,严禁擅自挪动!使用、洗涤时,必须佩戴乳胶或塑料手套!
进行琼脂糖凝胶电泳的操作前,应注意以下事项:
(1)准备干净的配胶板和电泳槽 注意:受到污染的配胶板和电泳槽可能含有DNA酶等,可能会降解DNA,造成条带信号弱、模糊甚至缺失的现象。
(2)选择电泳方法 一般的核酸检测用琼脂糖凝胶电泳即可;如果需要分辨率高的电泳,特别是只有几个bp的差别应该选择聚丙烯酰胺凝胶电泳;对于大的DNA分子则应使用脉冲凝胶电泳。
(3)正确选择凝胶浓度 琼脂糖凝胶电泳的可用浓度通常在0.5%~2%之间。低浓度的用于进行大片段核酸的电泳,高浓度的用于进行小片段分析。低浓度胶易碎,必须采用质量好的琼脂糖,并小心操作。浓度不适当的胶(与DNA分子大小不匹配)可能使分子大小相近的DNA带不易分辨,造成条带缺失现象。
(4)选择适合的电泳缓冲液 常用缓冲液有TAE(Tris-乙酸缓冲液)和TBE(Tris-硼酸缓冲液),TBE比TAE有着更好的缓冲能力。缓冲液一般应配制成母液置于4 ℃冰箱中冷藏,使用前再进行稀释。电泳时使用新制的缓冲液可以明显提高电泳效果。注意电泳缓冲液多次使用后,离子强度降低,pH值改变,缓冲性能下降,可能使DNA电泳产生条带模糊和不规则的DNA带迁移的现象。
(5)选择合适电压和温 度 电泳时电压不应该超过20 V/cm,电泳温度应低于30 ℃,对巨大的DNA电泳,温度应该低于15 ℃。注意如果电泳时电压和温度过高,可能导致条带模糊和不规则的DNA带迁移的现象。特别是电压太大可能导致小片段跑出胶而出现缺带现象。
(6)DNA样品的纯度和状态 注意样品中含盐量太高和含杂质蛋白均可以产生条带模糊和条带缺失的现象。乙醇沉淀可以去除多余的盐,用酚可以去除蛋白。注意变性的DNA样品可能导致条带模糊和缺失,也可能出现不规则的DNA条带迁移。在上样前不要对DNA样品加热,用20mM NaCl缓冲液稀释可以防止DNA变 性。
(7)Marker的选择 为了用目测法估算DNA条带所代表的相对分子质量大小,电泳时必须在同一块胶板上使用DNAmarker或已知大小的正对照DNA。应根据目标DNA分子的大小选择Marker,使目标分子形成的条带落在Marker条带较密的范围内,这样对目标片段大小的估计才比较准确。注意:在操作时,Marker作为样本的处理方法也要符合DNA电泳的操作标准流程。如果选择λDNA/Hind III或λDNA/EcoR I的酶切Marker,需要预先65 ℃加热5分钟,冰上冷却后使用。从而避免Hind III或EcoR I酶切造成的黏性接头导致的片段连接不规则或条带信号弱等现 象。
(8)DNA样本的上样 正确的DNA上样量和上样方法是条带清晰的保证。上样量太大可能造成“漂样”,导致DNA带型模糊;而上样量太小则导致带信号弱甚至缺失。TIANGEN公司DNA相对分子质量标准每次上样1~2 μL即可得到清晰均匀的条 带。
(9)凝胶的染色和观察 实验室常用的核酸染色剂是溴化乙啶(EB),染色效果好,操作方便,但是稳定性差,具有强烈毒性。其他系列如SYBR Green,GelRed,毒性小,但价格昂贵、操作条件比较苛刻。注意观察凝胶时应根据染料不同使用合适的光源和激发波长,如果激发波长不对,条带则不易观察,出现条带模糊的现象。
特别提醒:
●溴化乙啶(EB)具有强烈毒性,操作室必须佩戴乳胶或塑料的一次性手套,且应小心操作,切勿溅到皮肤上!
●佩戴手套操作时,严禁操作除染色盘之外的其他仪器,以免造成污染!
●操作完成后,手套必须按照规范摘下(摘下时翻过来),放入指定的垃圾桶,不得随意丢放!
电泳步骤如 下:
a)制备1%琼脂糖凝胶(大胶用70mL,小胶用50mL):称取0.7 g(或0.5 g)琼脂糖置于锥形瓶中,加入70mL(或50mL)1×TAE,瓶口倒扣小烧杯。微波炉加热煮沸3次,至琼脂糖全部熔化,摇匀,即成1.0%琼脂糖凝胶液。
b)胶板制备:取电泳槽内的有机玻璃内槽(制胶槽)洗干净,晾干,放入制胶玻璃板,取透明胶带将玻璃板与内槽两端边缘封好,形成模子。将内槽置于水平位置,并在固定位置放好梳子。将冷却至65 ℃左右的琼脂糖凝胶液混匀后小心地缓慢倒入内槽玻璃板上,使胶液缓慢展开,直到整个玻璃板表面形成均匀胶层。室温下静置直至凝胶完全凝固,垂直轻拔梳子,取下胶带,将凝胶及内槽放入电泳槽中。添加1×TAE电泳缓冲液至没过胶板1~2mm为止。
c)加样:在点样板或parafilm上混合DNA样品和上样缓冲液,上样缓冲液的最终稀释倍数应不小于1X。用20 μL微量移液器依次将样品加入胶板的样品小槽内(注意:加样前要先记录加样的顺序),每加完一个样品,应更换一个加样头,以防污染,加样时勿碰坏样品孔周围和底部的凝胶,以免造成漏样。胶板上有些孔可能因各种原因不符合要求,这些孔就不能使用,空置,但必须记录。
d)电泳:加样后的凝胶板立即通电进行电泳,电压60~100 V,样品由负极(黑色)向正极(红色)方向移动。电压升高,琼脂糖凝胶的有效分离范围降低。当溴酚蓝移动至距离胶板下沿约1 cm处时,停止电 泳。
e)电泳完毕后,取出凝胶,放入专用的染色盘中,用含有0.5 ug/mL的溴化乙啶1×TAE溶液染色约20分钟,再用清水漂洗10分钟。
f)观察照相:在紫外灯下观察,DNA存在则显示红色荧光条带,采用凝胶成像系统拍照保存。
8.3.12 UV—3000凝胶紫外分析仪

图8-15 凝胶紫外分析仪
UV-3000型高强度紫外分析仪仪器备用三种光源254 nm、365 nm及白光,仪器采用全封闭一体化暗箱,无需在暗室内操作,暗箱箱体设计观察口和两侧割胶窗口,方便对凝胶样品进行切割,拉开抽屉灯箱,即可自动关闭光源免受紫外线损伤。
(1)分析观察样品
①连接电源线:观察凝胶样品,用于制备观察以及切割等操作,以减少紫外线对DNA的损伤,请将波长开关365 nm或254 nm打开。选择好合适的波长后,就可以进行凝胶的观察、分析和切割等操 作。
②将电泳好的凝胶样品或薄层、纸层样品放在仪器中央,开启电源,使样品发出的荧光最清晰明亮。通常反射紫外离样品越近,则荧光越强。开机约3分钟,正是观察和拍照的最好时机,不可错过。
③如需要切片,双手伸入两侧的切胶口便可进行。
④紫外荧光板转换,直接把荧光板放在紫外灯箱上,即可实现紫外光与可见光之间切换,适用于蛋白凝胶分析。
(2)拍摄照片
①安上照相立架和固定螺丝。相机只要装上滤色镜即可。
②将相机镜头放进相机座中间圆孔内,当相机稳定后即可拍照。注意:调节相机镜头应事前准备好,才能适时抢拍。为了拍摄时稳定最好用快门线或其他装置。
(3)注意
①放置胶片前应关掉紫外灯开关,防止紫外线泄漏灼伤人体。
②使用前要把紫外滤光片上的保护膜撕去。
③观察后应及时关闭电源开关,以延长紫外灯的寿命。
④严禁用金属物和其他硬物直接接触紫外滤光片,以免刮花紫外滤光片。
⑤防止电泳液污染紫外滤光片。
⑥定期用无水乙醇清洁紫外滤光片,以防紫外滤光片发霉。
8.3.13 制冰机
制冰机是制备实验室用冰的专用仪器。使用时,应注意水源是否通畅。然后插上电源,按下显示屏正前方下面的开关按钮。即开始加水制冰。使用完毕关闭按钮。一般情况下,为常开。
特别提醒:实验室用冰切忌食用!
8.3.14 显微镜
显微镜是用于显微观察的专用精密仪器,应注意保护。
(1)拿取时,必须用双手。一手抓住显微镜的柄,另一手托住底座,保持水平,防止镜头滑落。
(2)使用时,应小心操作,避免用力过度或调节过快。特别是使用高倍物镜(40×和100×)时,应避免物镜与载物台两者相碰。调焦过程中,用粗准焦螺旋使工作台快速上升,将接近标本时,用细准焦螺旋调焦,并兼顾视场及物镜与标本的碰撞,缓慢地把像调清 晰。
(3)为弥补空气媒介对高倍率的吸收,可以使用100×油浸物镜。需要在标本片表面滴上一小滴合成浸油,使之形成浸油增透,使用完毕后先用擦镜纸擦去油滴,再用二甲苯或者(乙醚/乙醇=3/1)擦拭干净,最后再用擦镜纸擦干有机溶剂。擦拭时应按固定一个方向,以免划伤镜片。或使油浸入物镜,导致损坏,影响使用。
(4)工作台下的聚光镜座还装有滤光色片托架,平移托架,放入滤色片,以适用不同的标本效果。在使用紫外线作为光源时(荧光显微镜),必须使用防护滤色片,注意不要直视光源,避免眼睛受伤害。
(5)用完的载玻片要及时处理掉,物镜、载物台等要及时清理。(6)使用显微成像记录时,应避免放置显微镜的台子振动。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















