道尔顿遇到难题
18世纪和19世纪之交,英国出现了一位伟大的化学家——约翰·道尔顿。他在研究混合气体压力规律的同时,又总结了前人作过的大量化学实验,从而以敏锐的洞察力提出了一个涉及到化学发展的关键问题:化学有缺陷,化学需要一种真正可靠的物质结构理论来承担解释物质的一切属性和规律的任务。道尔顿出于对化学事业的使命感,在实验室、图书馆夜以继日地工作了整整4年,终于在1803年10月21日曼彻斯特文哲学会上宣读了关于原子的研究报告,也就是被誉为化学发展里程碑的“原子论”。
正当道尔顿埋头测量和计算各种元素的原子量的时候,法国年轻的化学界新秀盖·吕萨克(1778—1850)对气体状态的研究简直达到了痴迷的程度。他曾两次自制氢气球,第二次又一个人飞上海拔7016米的高空(需要何等的勇气!)去采集高空空气的样品,带回实验室进行分析,结果证明高空的空气和地面的并无两样。他发现了两项气体定律,盖·吕萨克第一气体定律就是我们在物理课中学到的关于温度与气体体积关系的定律,并且计算出气体体积膨胀温度系数为0.00375(现在测定的数据是0.00367)。盖·吕萨克第二气体定律是与德国化学家洪堡(1769—1859)共同提出的。洪堡在研究气体时,曾采用了错误的方法,因而导致了错误的结论。盖·吕萨克对洪堡的研究结果进行了实验核实后,发表了一篇论文,尖锐地批评了洪堡研究工作中的错误。对此,洪堡非但没有嫉恨盖·吕萨克,反而赞赏他的才华,并邀请他共同进行气体性质的研究。1803年,他们重新验证了24年前卡文迪许(1731—1810)做过的氢气与氧气化合生成水的实验,证实参加化合反应的氢气和氧气的体积比确实是2∶1。他们以12次实验数据为依据,于1805年联名发表了第一篇论文,说明气体反应的反应物体积之间呈简单整数比关系。但是这仅仅是研究工作的开始,因为这种简单整数比关系是否适用于其他的气体化合反应还有待验证。他们对氧气和一氧化碳、氧气和二氧化硫、氢气和氯气、氨气和氯化氢气体等多种参加反应的气体的体积做了精确的测定,发现这些气体相化合的体积也都呈现简单整数比。1808年12月31日盖·吕萨克第二气体定律(也称为气体反应体积定律)诞生了。
盖·吕萨克还有一项重要发现:有些气体化合反应的生成物的体积出乎意料,如2体积氢气与1体积氧气反应生成2体积水蒸气,1体积氢气与1体积氯气反应生成2体积氯化氢,1体积氮气与1体积氧气反应生成2体积一氧化氮……为什么生成物是2体积而不是1体积呢?怎样解释这些实验事实呢?盖·吕萨克想求助于道尔顿的原子论,认为很可能是由于化合时气体的原子个数的整数比才导致了化合时反应物气体体积以及反应物和生成物气体体积呈整数比,他殷切地希望能得到已负盛名的大科学家的支持。然而盖·吕萨克大失所望,因为道尔顿的原子论并没有把原子和分子的概念清楚地区分开,他把化合时参加反应的粒子(这是不可分的)叫原子,把单质或化合物的粒子也叫原子(化合物粒子可分,单质粒子有的可分,有的不可分)。虽然当时已有“分子”这个名词,但科学家们把它仅仅看作“原子”的同义词。按照原子论观点气体反应体积定律应有如下的表示:
氧+→氮一氧化氮
实验结果 1体积+1→体积2体积
按原子论 M原子+M→原子2M原子
或 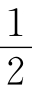 原子+
原子+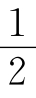 →─原子1原子
→─原子1原子
如果同体积气体中的原子数目相同的话,这岂不是意味着原子可以分裂成两半吗?但这是不可能的,道尔顿对自己的理论深信不疑,却怀疑甚至否定盖·吕萨克的实验结果。于是,他着手检查盖·吕萨克的实验结果,但事实胜于雄辩,盖·吕萨克的实验结果经得起检验。怎样解释这些事实呢?道尔顿的原子论真的陷入了困境。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















