三、医疗器械风险分析
医疗器械风险分析(ISO 14971-1:1998),主要是研究医疗器械的随机失效事件,对危害的发生概率及伤害的严重程度进行定性乃至定量分析,并判定医疗器械的可接受性,以决定医疗器械对其预期用途的适宜性的一份重要标准。全国医疗器械质量管理和通用要求标准化技术委员会已将此项标准转化为医疗器械行业标准(YY/T 0316-2000)。
1.医疗器械风险分析的发展和重要性
总结宇航、核电站及其他有关工业方面进行风险分析的经验,以及在医疗器械使用中出现伤亡事故的实例,使得各国医疗器械管理当局和制造者感到实施风险分析和风险控制的必要性。国际标准化组织ISO/TC 210于1995年就着手“风险分析对医疗器械的应用”工作草案的起草工作,1997年3月由ISO/TC 210和IEC/SC62A成立了联合工作组JWG1,代替原有的第四工作组WG4,加强了“风险管理对医疗器械的应用”有关标准的制定工作,1997年11月10日对ISO/FDIS 14971-1投票,获得通过,1998年10月1日发布ISO 14971-1第一版“风险管理第一部分风险分析的应用”。与此同时,还在抓紧ISO 14971-1的第二版ISO 14971“风险管理对医疗器械的应用”国际标准的制定,它扩展了ISO 14971-1的内容,包含了风险管理的最低要求。
美国食品药物管理局(F'DA)根据近20年的长期实践、修改,在吸取大量临床使用意见的基础上,于1996年发布了第三版的“医疗器械质量体系规范”,FDA公布了1983年3月至1989年9月期间发生的医疗器械自市场撤回的评价结果,发现在这六年间导致自发收回行为的质量问题的44%归因于设计错误或缺陷,而这些有可能被充分的设计控制所避免,而从1983财年到1991财年与软件相关的回收问题表明,所有与软件相关的器械问题90%以上均起因于与设计相关的错误。为此,除采用加强设计控制的措施外,还要求在设计全过程中对医疗器械的风险进行分析。欧洲1993年6月14日生效的欧共体理事会关于医疗器械的导则(93/42/EEC)和1998年10月27日生效的关于体外诊断器械的导则(98/79/EEC)也规定了风险分析的要求。
因此,除了要求医疗器械满足一系列有关安全性标准要求外,还要对和医疗器械使用有关的风险,即危害的发生概率及伤害的严重程度进行定性乃至定量分析,并判定其可接受性如何,以决定医疗器械对其预期用途的适宜性。
风险分析和管理主要规定了判定危害和风险分析的程序,主要涉及与医疗器械有关的危害,这种主要是随机失效事件的研究(当然也有系统失效),要求把风险量化,至少是具体的定性分析,以便确定医疗器械的安全性。
另外,还有器械在正常情况下的风险分析和事故率的统计数据,都是使风险量化的重要来源。同样满足安全标准要求,仍有不同技术途径和设计方案,其带来的风险是各不相同的。
ISO 14971-1中既没有对技术安全的具体要求,也不规定具体的技术途径,它只规定了进行风险分析的程序,主要涉及随机事件的分析,因此它和其他安全标准是相辅相成的。
风险分析的重要性还可归纳为如下几点:
(1)只有进行风险分析才能知道风险的大小,对其加以控制,根据市场需求、周期费用等,制定风险的可接受准则。
(2)只有进行风险分析,才能对器械的安全性作出判断,只有对安全性作出判断,才能决定器械对预期用途的适宜性。否则器械的风险和安全性将处于失控状态。
(3)风险分析是研制医疗器械必不可少的关键过程,是十分重要的关键和特殊的过程。
(4)通过风险分析可以识别关键件和关键故障模式。
2.医疗器械的风险管理标准框架
ISO 14971-1由ISO/TC21O和IEC/SC62A组成的第一联合工作组JWG1制定,名称是风险管理第一部分:风险分析的应用。工作组名称为风险管理对医疗器械的应用。该组将医疗器械的风险管理活动分为五大步骤和十四步具体活动,具体活动如图8-11所示:
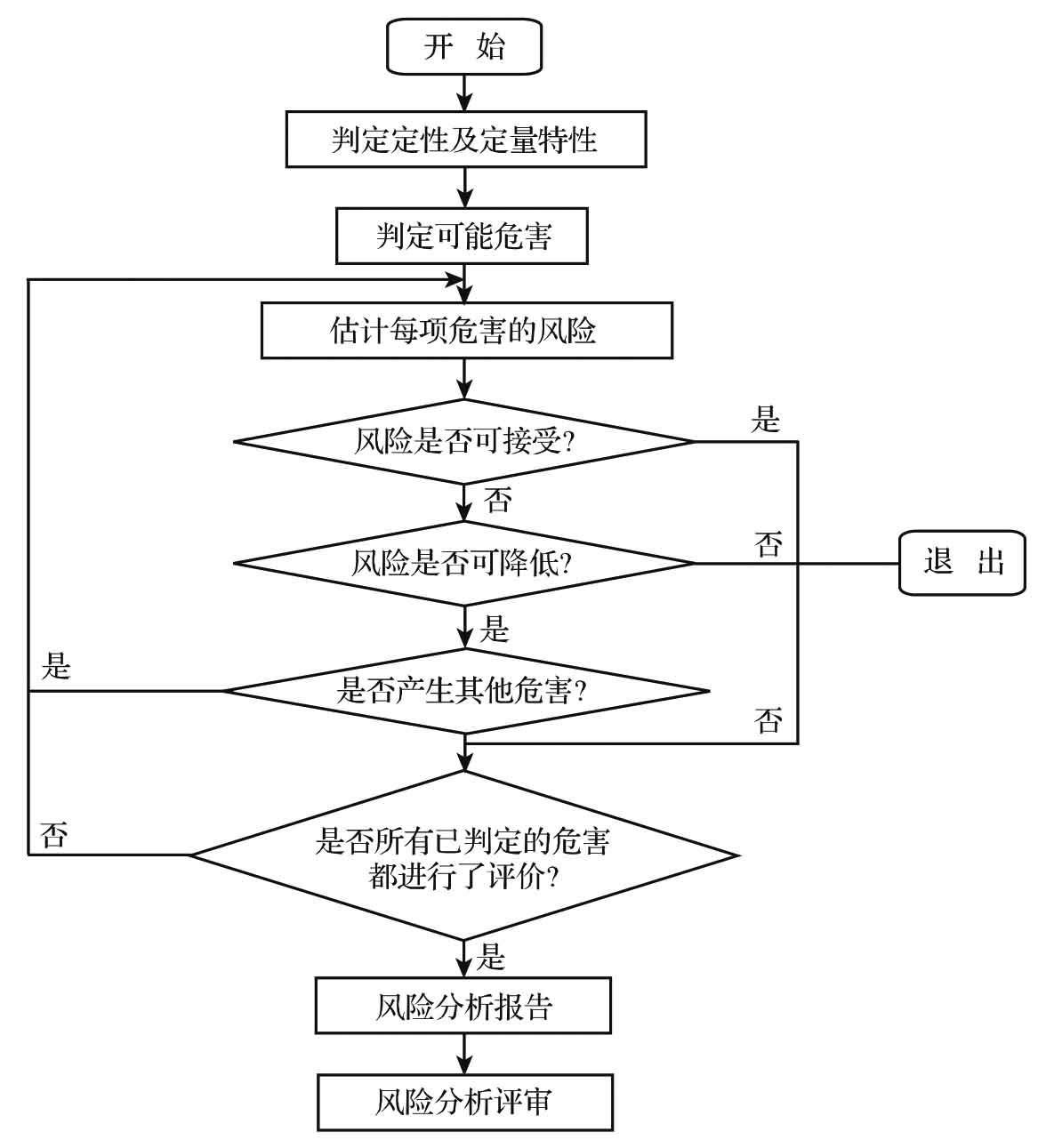
图8-11 医疗器械的风险管理标准框架
3.医疗器械风险分析基本内容
(1)基本概念
风险分析是风险控制(风险管理)的基础。此标准是利用风险分析的技术对与一种医疗器械应用有关的假想事件的可能后果的概率进行定量或定性估计。利用可得到的资料,按照规定的程序,通过判定与一种器械有关的危害并估计其风险,研究其安全性。影响医疗器械安全性的因素包括:有关社会的社会经济和教育背景,以及实际和设想的患者处境与状态。这种判断必须考虑到器械的预期用途、性能、风险和益处,以及与临床过程有关的风险和益处。
(2)分析过程
第一步:医疗器械定性和定量特征的判定。
①预期用途是什么和器械如何使用?主要关于谁用(所需技能、残疾人、老人、儿童)、使用环境、谁安装、器械是否可控或受人因素影响?
②器械是否预期要与患者或其他人接触,考虑预期接触、表面接触、有创接触、植入及接触的时间和频次?
③器械中装入或使用了什么材料和/或部件?与安全特性有关的特征是什么?
④是否有能量施加于患者和/或由患者身上吸收?
⑤是否有物质进入患者体内和/或由患者身上抽取?
⑥生物材料是否由器械处理以便随后再用?
⑦器械是否以无菌形式提供或准备由用户灭菌,或可用其他的微生物控制方法处理?
⑧器械是否用以改善患者的环境?
⑨器械是否进行测量?
⑩器械是否能处理分析?
 器械是否用以控制其他器械或药物与其相互作用?
器械是否用以控制其他器械或药物与其相互作用?
 是否有不希望产生的能量或物质输出?
是否有不希望产生的能量或物质输出?
 器械是否对环境变化比较敏感?
器械是否对环境变化比较敏感?
 是否有器械的基本消耗品或附件?
是否有器械的基本消耗品或附件?
 是否需要维护和/或校准?
是否需要维护和/或校准?
 器械是否含有软件?
器械是否含有软件?
 器械是否有限定的贮存寿命?
器械是否有限定的贮存寿命?
 可能延迟的和/或长期使用效果如何?
可能延迟的和/或长期使用效果如何?
 器械是否受到什么机械作用力?
器械是否受到什么机械作用力?
 什么决定器械的寿命?
什么决定器械的寿命?
 器械预定是一次性还是可重复使用?
器械预定是一次性还是可重复使用?
第二步:判定可能的危害。
能量危害指电、热、机械力、电离辐射、非电离辐射、电磁场、运动部件、悬挂质量、患者支架失效、压力(容器破裂)、声压、振动、磁场(MRI)。
生物学危害指生物污染、生物不相容性、不正确的输出(物质、能量)、不正确的配方(化学成分)、毒性、变态反应、过敏性、突变性、致畸性、致癌性、交叉感染、致热性、退化、降解。
环境危害指电磁干扰、能源或冷却剂的不适当供应、冷却的限制、与其他器械的不兼容性、意外的机械破坏、由于废物和/或器械处置的污染。
有关器械使用的危害指不适当的标签、不适当的操作说明书、不适当的附件规范、不适当的使用前的检查、过于复杂的操作说明书、没有操作说明书或说明书被拿走、由不熟练的/未经训练的人员使用、合理地或预见的误用、对副作用的警告不充分、对一次性使用医疗器械可能被重复使用的危害警告不适当、不正确的测量及其他计量制问题、不正确的诊断、错误的数据传递、结果显示错误、与消耗品/附件/其他器械的不兼容性。
由功能失效,维护及老化引起的危害指与预期用途不相适应的性能特征,缺少或不适当的维护规范,包括不适当的维护后的功能检查规范、不适当的维护、缺乏适当的终止器械寿命的规定、失去器械完整性、不适当的包装(器械污染和/或变质)、不恰当的重复使用。
第三步:对每项危害的风险进行估计。
对经判断的每项可能危害,利用可得到的资料/数据(有关标准、科学资料、已使用的类似器械所得的资料包括公开发表的报告的故障、临床证据、适当的调查结果),估计在正常及故障两种状态下所有的风险。
风险估计应检查初始事件或环境,所涉及事件的序列,任何降低已判定的危害的可能、有害后果的性质和频次,并采用定量或定性的方法进行分析。如危害发生在无失效、发生在一种失效模式下、发生在多重故障状态下的情况。
第四步:进行风险的评审。
如果一个给定的危害风险按照有关标准进行了适当的阐明或用其他方式证实了其可接受性,则可进行第七步所有已判定的危害的评估。
如这种给定的危害风险超出了可接受性的水平,则要进行第五步风险的降低。
当风险仅在失效模式下才出现不可接受性的问题,有危害发生前用户能否发现失效;能否通过更有效的制造控制或预防性维护消除;错误的使用是否会增加失效的可能性;能否增加报警装置等。
第五步:风险的降低。
适当降低,有效则进行第六步其他危害的产生,否则退出。降低的手段采用直接安全设计、间接安全防护,其中防护包括限制可达性(如辐射防护),危害的防护(如采用保护盖),附有说明的安全方式(如限制器械的使用时间和频次、限制用途、寿命或环境),重新确定预期用途。
第六步:其他危害的产生。
确定在采取降低风险的过程中是否有新的危害产生。
第七步:所有已判定的危害的评估。
所有已判定的危害均进行了评估,则进行第八步风险报告,否则返回第三步重新估计每项风险。
第八步:风险报告,将前七步风险分析的结果形成文件。
制造商根据风险报告对此产品进行设计,达到风险管理目的。风险报告也是各国政府在产品上市前进行审查及取得CE标志时应提供的技术文件中一份必备文件。
在风险分析标准中,风险分析第四步,进行风险的评审中指出,如果一个给定的危害风险在有关标准进行了适当的阐明,则证实了其可接受性。而对于产品中的安全问题在有关的各级安全标准中均有论述。
4.医疗器械风险分析标准
医疗器械由于是一种有使用风险的产品,为了能有效地控制其产品质量,长期以来国际ISO、IEC组织为此做出了积极的努力,各医疗器械标准化技术委员会制定大量的国际标准,其重要的医疗器械标准有:
医疗器械风险分析(ISO 14971——YY/T0316-2000)
医用电气安全要求(IEC 60601系列——GB 9706系列)
医疗器械生物学评价(ISO 10993系列——GB/T 16886系列)
消毒、灭菌标准(ISO 11134、11135等——正在转化中)
医疗器械质量体系标准(ISO 13485、13485——YY/T 0287、0288)
这些医疗器械标准已基本覆盖了主要医疗器械产品的安全方面要求,构成了医疗器械安全方面的标准化体系。为与国际接轨,上述标准已被逐步转化为我国相应的医疗器械国家标准和行业标准。理解和掌握这些标准,将为医用电子仪器制造技术人员和医疗现场对医用电子仪器进行保养检查的相关医疗人员更好地做好医用电气安全工作打下扎实的基础。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。

















