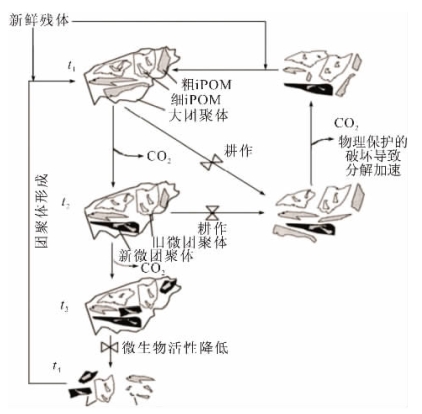
图1-6 团聚体形成示意图(据Six et al,2000)
土壤结构在调节土壤中许多的物理和生物过程时是主要因素(Mikha,Rice,2004),土壤团聚体是土壤的基本组成单位,他们的形成和稳定性不仅能决定土壤的通气性和储水能力,而且能通过有机质把有机碳固定保留在团聚体中(Abiven et al,2009;Mikha,Rice,2004)。图1-6是土壤团聚体形成与破坏过程示意图。由于存在于不同粒级团聚体中的碳,其周转周期(turnover)差异较大,从小于一年到上千年。因此,团聚体分组和密度分组被广泛应用于土地利用、不同植被覆盖下的湿地土壤有机碳库稳定性影响的研究(Jagadamma,Lal,2010;Six et al,1998;Yang et al,2009;Zhang et al,2007;李海波等,2008)。不同粒级的团聚体具有不同的碳含量及稳定性。保存于大团聚体的碳,具较低的碳分解速率和更长的周转速率,因此较大团聚体(>250μm)含量越高,土壤结构越稳定,保护碳的功能越好(Saha et al,2010;Tisdall,Oades,1982)。大团聚体的形成是微团聚体和粉—黏团聚体通过有机碳的胶结形成的(Puget et al,2000;何淑勤,郑子成,2010)。利用13 C示踪法证实随着时间标记的碳从大团聚体到小团聚体进行了重新分配(Angers et al,1997;Gale et al,2000;Jastrow et al,1996;何淑勤,郑子成,2010),由此表明微团聚体在大团聚体内形成(Elliott,Coleman,1988;Golchin et al,1994)。大团聚体比微团聚体含更多的有机碳。由于土壤团聚体粒级和结构的不同,导致不同粒径团聚体的有机碳在数量上和稳定性方面均存在一定的差异(Barrios et al,1997;Beare et al,1994;Gregorich et al,1995;何淑勤,郑子成,2010)。影响土壤团聚体的因素都可影响土壤碳的数量和质量(Christensen,1996;何淑勤,郑子成,2010)。
一、土壤团聚体分离方法
有关表层样与柱状样的采集方法及相关的化学测试同上,这里不再赘述。下面仅就用于团聚体分组与土壤颗粒有机质的样品特别要求说明如下。
在野外调查的基础上,根据湿地植被的覆盖率等因素选择典型湿地生态环境类型。在各个典型样地分别按照10.0m×10.0m样方,在4个角各取一根30cm深度的短柱,野外分割样品,10cm一个,将4个点相同深度的样品做一个混样,用自封口塑料袋封装。同时,采用环刀法测定不同深度上的土壤容重。
将采集的土样迅速带回实验室,各取30g土壤测定含水量,部分在室内风干,其余置于冰箱保存。用手轻轻地弄碎土壤,过8mm筛,土壤风干的过程中时常翻动,并将较大的残茬和根去除。将风干土充分混合并取出部分(约10g)用于测定总碳、氮、有机碳及有效态提取液,其余在室温下保存,用于团聚体和密度分组。
获得符合要求的样品后,团聚体分离方法如下。
(1)土壤团聚体的分组:采用湿筛法(Six et al,1998)。
团聚体分离的具体方法步骤见图1-7,即逐级通过2000μm、250μm和53μm的筛,获得4个粒级的团聚体:①>2000μm(粗大团聚体);②250~2000μm(细大团聚体);③53~250μm(微团聚体);④<53μm(粉—黏团聚体)。具体操作为:室温下,称取风干土壤50g,置于2000μm的筛上,在去离子水中浸润5min,目的是破坏不稳定的团聚体;然后以50次/2min的频率在去离子水中手动振荡2min,上下振幅为3cm,将筛上的团聚体冲洗到烧杯中,通过筛的泥土混合物再依次通过250μm、53μm的分样筛,重复以上操作。将装有各级团聚体的烧杯在50℃条件下烘干,称重,计算得到各级团聚体的质量分数,然后将各组分的样品保存于干燥器中用于密度分组。
(2)土壤颗粒有机质的分离:采用密度分离法(Six et al,1998)。
分离自由轻组、包裹态颗粒有机质和矿物结合态有机质流程见图1-7。团聚体分组后,将250~2000μm和53~250μm粒级团聚体进行密度分组前,放入105℃烘箱中烘干过夜,放入干燥器中冷却至室温。分别称取各粒级团聚体样品5g,倒于事先已加入35mL 1.85g/cm3多钨酸钠的离心管,将盖有塑料盖的离心管轻轻地上下颠倒5次,避免破坏团聚体,残留在瓶盖和管壁的物质用10mL多钨酸钠溶液冲入悬浮液中,悬浮液平衡30min,室温下离心(2000r/min)30min(Ford et al,1969)。悬浮液不能立即离心,否则会由于离心过程中轻组颗粒的吸附机制而导致回收率较低。为了便于分离出轻组颗粒而不受较重颗粒的污染,有必要充分离心使重组物质沉淀于离心杯底。将上层清液中漂浮的物质(即轻组)倒入放置好20μm尼龙滤网的微孔过滤器并真空抽滤,用去离子水彻底冲洗,以除去多钨酸钠溶液,并将分离出的组分连同滤网一起在50℃下烘干。用刷子将烘干的轻组物质从滤网表面刷下来并称重(Golchin et al,1994)。离心管内的重组颗粒用去离子水冲洗两次,于0.5%的六偏磷酸钠溶液中分散,在往复式振荡器(200r/min)震荡18h,分散的重组颗粒根据分析的团聚体大小分别过2 000μm、250μm及53μm的筛,留在各粒级筛上的物质在50℃下烘干并称重,研磨,用来测定包裹态颗粒有机质的有机碳浓度。
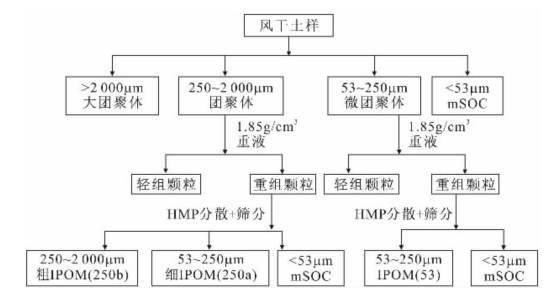
图1-7 土壤团聚体和颗粒有机质分离流程(Six et al,1998)
(图中:mSOC为矿物结合态有机碳;HMP为六偏磷酸钠溶液;Coarse iPOM为250~2000μm粗颗粒有机质;Fine iPOM为53~250μm细颗粒有机质)
(3)总碳、有机碳浓度的测定。
总碳和有机碳的浓度均用元素分析仪测得。土壤总有机碳、团聚体分组和密度分组有机碳测试前处理方法如下。
土壤总有机碳样品前处理方法:样品研磨至200目下,称取1g左右,装入8mL玻璃瓶中,往玻璃瓶中缓慢加入1滴管4mol/L HCl溶液,使其与无机碳反应的量处于过饱和状态,重复几次,摇匀,确定最后一次加入HCl溶液后无气泡冒出,待所有样品均加完酸并再次摇匀后,静置1h后,离心(2 250r/min,10min),去除上清液,加入超纯水,振荡摇晃使其混合均匀后,超声5min,擦干,离心(2000r/min,10min),重复操作,直至用pH试纸检测上清液呈中性。将洗净的样品在55℃下烘干24h,烘干后在干燥器中平衡24h,将干燥并平衡好的样品研磨并使其均质化,称取适量的样品上机测试。
密度分组粗细颗粒有机质样品量少,故有机碳的前处理方法有所改进,此方法主要适用于样品量较少的有机碳浓度测定,与Verardo的描述相似(Verardo et al,1990)。具体方法是:把银杯放入小的铝板上,将少量样品(20mg)放入银杯中,每个样品先加入10μL去离子水,再加入10μL 6%的亚硫酸溶液,并放置,同时打开加热板,温度设置为70℃。反应停止后,再加入10μL 6%的亚硫酸溶液,加足够的酸完全除去碳酸盐,处理完毕后,使样品干燥并使用美国生产的PE2400II型元素分析仪测试。
(4)土壤样品其他指标的测定。
土壤容重测定——环刀法:采用环刀试验,记录土样的体积和每个样品总重,计算土壤的容重。
土壤含水量测定——称重法(也称烘干法):用0.1g精度的天平称取土样的重量,记为土样的湿重,在105℃的烘箱中烘干24h至恒重,然后称取烘干后土样的质量,记为土样的干重,利用公式:
土壤含水量(%)=(烘干前锡纸及土样质量-烘干后锡纸及土样质量)/(烘干后锡纸及土样质量-锡纸质量)×100;
土壤pH值测定:大量的样品烘干,研磨,过2mm的筛,将土样与去离子水按1∶2的体积比例平衡一周(模拟湿地的环境),然后使用梅特勒-托利多(Mettler Toledo)SevenMulti型pH/电导率/离子综合测试仪测试pH值;
土壤有效态营养元素测定:将风干土研磨至10目以下,称取2.5g左右加入100mL提取瓶中,后加入25mL Mehlich-Ⅲ提取液,将混合物放置于200r/min的往复式振荡器上振荡5min,振荡结束后,离心20min,取上清液,稀释10倍,用ICP仪器测定有效态营养元素浓度。其中Mehlich-Ⅲ提取液由0.2mol/L CH3COOH、0.25mol/L NH4NO3、0.015mol/L NH4F、0.013mol/L HNO3及0.001mol/L EDTA溶液配制而成。为了配制1L的Mehlich-Ⅲ提取液,将11.49mL浓缩的CH3COOH溶液、20g NH4NO3、0.56g NH4F、0.84mL浓缩的HNO3溶液及0.29g EDTA加入800mL去离子水中,混匀,用去离子水定容稀释到1L。
(5)数据处理与分析。
各种湿地土壤性状值为3次重复的算术平均值。重液分离轻重组分后,由于无法确保操作中是否完全将多钨酸钠重液清洗干净,故矿物结合态颗粒有机质含量通过差值进行计算。
运用SPSS17.0中相关分析的单因素方差分析比较相同粒级下不同湿地类型或深度间的差异,数据的相关性分析采用Pearson’s相关系数评价;平均重量直径与土壤有机碳的线性关系图用Excel 2007绘制;图件采用CorelDRAW Graphics Suite X3和Grapher 4.0等绘图软件完成。显著水平为p<0.05认为有意义,否则认为无统计学意义。
二、土壤团聚体稳定性评价
由于土壤不同粒级水稳性团聚体分布较为复杂,通过团聚体平均重量直径和大团聚体细颗粒有机质与粗颗粒有机质的比值这两种方法来评价土壤团聚体的水稳定性,从而揭示土壤碳的周转周期及其稳定性。
(1)平均重量直径(MWD)。
平均重量直径(MWD)是反映土壤团聚体大小分布状况的常用指标。土壤中大团聚体的含量直接影响着MWD值的大小,粒级>250μm的水稳性大团聚体的含量越高,MWD的值越大,MWD值越大表示土壤团聚体的团聚度越高,稳定性越好。图1-8为辽河三角洲不同湿地类型不同深度上土壤的MWD值。从不同湿地类型来看,芦苇土壤MWD值显著高于水稻和翅碱蓬;从不同土壤深度看,芦苇土壤团聚体MWD值0~10cm表层高于10~20cm和20~30cm,不同层次间差异较大,水稻和翅碱蓬土壤MWD在10~20cm最大,不同层次间差异较小。总体而言,团聚体稳定性顺序为芦苇湿地>水稻田湿地>翅碱蓬湿地。土壤团聚体平均重量直径的值越大,土壤结构越稳定,土壤抗侵蚀能力越强。由此说明芦苇湿地土壤碳的保存结构最稳定。
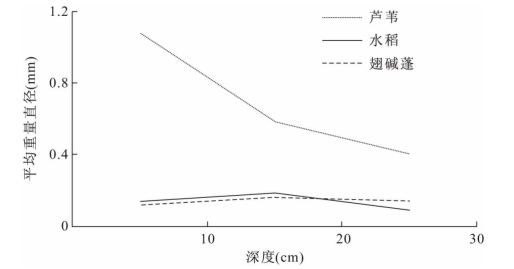
图1-8 不同深度下土壤团聚体平均重量直径变化
(2)土壤平均重量直径与有机碳浓度的关系。
土壤有机质是团聚体间主要的胶结物质,土壤有机碳浓度与水稳性团聚体的数量有关。由图1-9得出如下认识,MWD随有机碳浓度的增加而增大,且变化趋势呈二次多项式正相关关系。也即是说土壤平均重量直径越大,土壤结构越好,稳定性越好,土壤有机质含量对土壤结构的贡献越大。
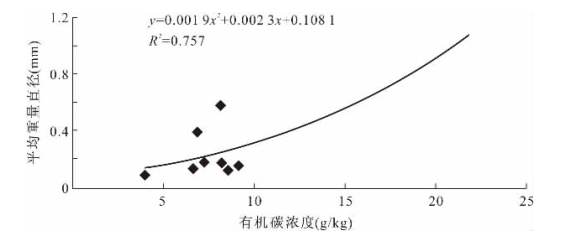
图1-9 土壤有机碳浓度与平均重量直径的线性关系
(3)细颗粒有机质与粗颗粒有机质比值。
大团聚体内细颗粒有机质与粗颗粒有机质的比值可以作为评价大团聚体周转速率的指标。图1-10为辽河三角洲不同湿地类型在0~10cm表层细颗粒有机质与粗颗粒有机质的比值。该图揭示了在0~10cm表层,芦苇湿地的大团聚体周转速率比水稻田、翅碱蓬湿地的大团聚体周转速率慢2~7倍。由此表明,芦苇湿地土壤大团聚体具有较好的稳定性,而水稻田湿地由于耕作的影响,不利于大团聚体的保存,翅碱蓬湿地受潮汐作用和其他因素影响,使得表层大团聚体周转速率较快。
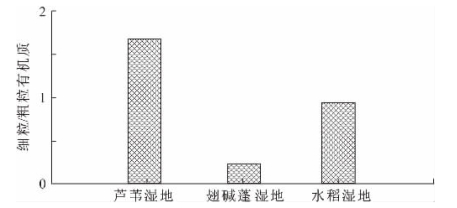
图1-10 0~10cm表层包裹态细颗粒有机质与包裹态粗颗粒有机质比值
三、土壤有机碳库稳定性评价
土壤有机碳库的稳定性是评价土壤固碳长期潜力的重要指标(Sébastien et al,2007;Trumbore,Czimczik,2008),依赖于不同活性土壤有机碳库的储量和组成(Sollins et al,1996)。土壤中大团聚体的含量能够指示土壤保护碳的功能。用平均重量直径(图1-9)、细颗粒有机质与粗颗粒有机质的比值(图1-10)两个指标来评价大团聚体的稳定性,结果表明芦苇湿地土壤的大团聚体稳定性最好,水稻田湿地次之,翅碱蓬湿地最差。不同湿地类型土壤中轻组有机质所占的比例均较低,有机碳主要富集在重组中,特别是矿物结合态有机碳,这部分有机碳最稳定,属于惰性库,可视为有机碳分解的最终产物。团聚体分组中粉—黏团聚体所占的比例最高,密度分组中矿物结合态颗粒有机碳所占分数高于90%,均为翅碱蓬湿地>水稻田湿地>芦苇湿地。由此说明大部分有机碳已被破坏,在分解过程中形成了其最终产物而进入惰性库,且翅碱蓬湿地的有机碳被分解得最完全,其次是水稻田湿地,芦苇湿地的有机碳相对地得到了较好的保护。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














