第三节 肾小球硬化的发生机制
肾小球硬化(glomerulosclerosis,GS)是各种肾小球疾病,包括原发性肾小球肾炎,如膜性肾炎、膜性增生性肾炎、新月体肾炎、局灶节段性肾小球硬化症等,以及继发性肾小球病,如狼疮性肾炎、IgA肾病、紫癜性肾炎、糖尿病肾病、肾淀粉样变性病等病理过程进展的共同结局,也是引起肾病患者出现慢性肾衰竭,最终导致尿毒症的重要病理基础之一。实验动物证实,肾小球硬化是一个渐进性过程,初期肾小球呈现局灶节段性肾小球硬化(focal segmental GS,FSGS),后期则发展为弥漫性球性肾小球硬化(diffuse global GS,DGGS)。病理上,当其硬化的肾小球数超过其总数的75%时,则可称为硬化性肾小球肾炎(sclerosing GN)。此时,残存的肾小球就难以对其丧失的功能进行代偿,患者将不可避免地发生肾衰竭,而且其肾脏体积也显著缩小,重量减轻,质地变硬,表面呈弥散细颗粒状或可形成许多凹陷性瘢痕,这样的肾脏称为终末期肾(end stage kidney),也可称为肾硬化(nephrosclerosis)。
肾小球硬化的发病机制十分复杂,但近年来通过对体外培养的肾小球及其固有细胞和各种肾炎动物模型的实验研究,对其认识取得了长足进步。本节着重介绍有关肾小球硬化的物质基础、启动因子、代谢过程和信号转导通路等方面。
一、细胞外基质
细胞外基质(extracellular matrix,ECM)是构成正常GBM和系膜基质的主要成分,也是肾小球硬化的重要物质基础。目前经对其组成成分的分析,主要发现有下列几种。
(一)胶原
胶原(collagen)是构成细胞外框架的主要蛋白。其基本亚单位是原胶原分子,后者的基本结构单位是α肽链,至今已知者有34种,富含甘氨酸、脯氨酸和羟脯氨酸。3条同源或异源性α肽链相互缠绕成绳索状结构,组成不同类型的胶原,目前已知至少有19种型别,分为3种类型。①间质型胶原:又称原纤维胶原,由典型的3股绳索状的胶原分子组成,以聚合的纤维形式存在,具有宽约67 nm的横纹周期,其分布于细胞或组织之间。其中Ⅰ、Ⅲ型胶原广泛存在于皮肤、各器官结缔组织中,以及集中分布在肾小球及肾小管周围的间质中,而Ⅱ型胶原则见于软骨内,Ⅴ、Ⅵ型胶原也广泛存在于间质组织中。②基膜型胶原,主要是Ⅳ型胶原,存在于基膜和系膜区中,其分子呈间断的螺旋形,它与层连蛋白(laminin,Ln)及其他蛋白聚糖等共同构成肾小球和肾小管的基膜。其他还有Ⅶ、Ⅷ、ⅩⅨ等。③原纤维相关胶原,主要是Ⅸ、Ⅻ、ⅩⅣ等,其主要特点是由3股螺旋的胶原区与球形的非胶原区(NC)组成,后者可使胶原分子具有变形及结合糖胺聚糖等功能,广泛分布在软骨、较致密结缔组织等,主要对其他胶原纤维起修饰调节等多种作用。
(二)弹性蛋白
弹性蛋白(elastin)的基本单位是原弹性蛋白,富含甘氨酸、丙氨酸、赖氨酸和缬氨酸,极少含有脯氨酸的小区段。原弹性蛋白肽链形成一些特殊类型的螺旋,其间插有含赖氨酸和丙氨酸的小区段,从而使其具有拉伸和收缩特性。弹性蛋白的周围尚有微纤维(microfibrils),后者由肌原纤维蛋白组成。在结缔组织中,丰富的弹性纤维常与胶原纤维交织在一起,构成弹性结缔组织,其主要分布于血管、皮肤、肺、子宫和韧带等部位,以维持组织或器官的抗牵拉作用,使其富有弹性。
(三)蛋白聚糖
蛋白聚糖(proteoglycan,PG)是由大量糖胺聚糖(又称氨基多糖,glycosaminoglycan)与少量核心蛋白质构成的糖肽复合物。PG是一种无处不在的蛋白质家族,存在于细胞表面、细胞内囊泡或与ECM其他成分结合。糖胺聚糖富于多聚阴离子,呈酸性。
根据多糖残基的性质、连接方式及硫酸基的数量等,PG大致可分为4类:①透明质酸(hyaluronan);②硫酸软骨素(chondroitin sulfate)和硫酸皮肤素(dermatan sulfate);③硫酸类肝素(heparan sulfate)和肝素(heparin);④硫酸角质素(keratan sulfate)。此外,因核心蛋白及结合糖胺聚糖种类的不同,还可形成许多种的蛋白聚糖,如β-蛋白聚糖(beta-glycan)、饰胶蛋白聚糖(decorin)、双链蛋白聚糖(biglycan)、纤调蛋白聚糖(fibromodulin)、聚集蛋白聚糖(aggrecan)、基膜蛋白聚糖(perlecan)等。
PG的功能主要包括:①分子筛孔作用,如基膜蛋白聚糖等组成的GBM可阻止蛋白的过滤;②传递分子信息,如成纤维细胞生长因子与硫酸类肝素结合才能激活前者受体及饰胶蛋白聚糖,并与TGF-β受体结合而抑制TGF-β的激活;③结合蛋白酶或其抑制剂,参与细胞迁移、释放、储存和ECM降解过程;④某些蛋白聚糖可整合于细胞表面,或与整合蛋白一起介导细胞骨架与ECM结合而对各种生长因子发生反应等。
(四)黏合性糖蛋白
黏合性糖蛋白(adhesive glycoprotein)也是ECM家族中的重要成员,为非胶原性黏合性蛋白,后者由多个功能区组成,内含可与其他基质大分子或细胞表面受体结合位点,从而对细胞或ECM的一些成分有特异性整合作用。已知有下列几类:①纤连蛋白(fibronectin,Fn)。由两个亚基组成二聚体,每个亚基含5~6个功能区,后者由Ⅰ、Ⅱ、Ⅲ型重复系列组合而成,其中Ⅲ型重复系列含有专一的三肽,即精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)系列,后者可与细胞表面受体,即整合蛋白结合,参与细胞的多种生理功能。此外,纤连蛋白又通过其功能区与胶原、纤维蛋白、肝素等结合,可促进血凝及创伤愈合。②层连蛋白(laminin,Ln)。由3条长肽链(α、β1和β2链)组成,并通过二硫键连成一不对称的十字架形,其分子中的多个功能区可分别与Ⅳ型胶原、硫酸类肝素及其他糖蛋白或细胞表面的相应受体结合,是构成基膜的非胶原糖蛋白,促进细胞与基膜Ⅳ型胶原的黏合作用。③其他黏合性糖蛋白。包括巢蛋白(entactin,Et; nidogen,Nd)、玻连蛋白(vitronetin,Vn)、腱生蛋白(tenascin,Tn)、凝血酶敏感蛋白(thrombospondin,Ts)、波状蛋白(undwlin,Ud)、促成骨蛋白(osteopontin,Op)、软骨黏连蛋白(chondronectin,Cn)、骨黏连蛋白(osteonectin,On)等,它们均可通过对有关细胞或ECM成分的黏合作用,维持组织结构的完整性并参与细胞的各种生理功能。
在病理情况下,ECM合成、分泌增加,继而发生在肾小球内的过度沉积,是导致肾小球硬化的主要作用环节。肾小球的各种病变,如血管襻坏死、固有细胞增生、基膜断裂或增厚、系膜基质增多、炎症细胞浸润、渗出物过多、肾球囊壁破坏等的最终结果,均可引起肾小球硬化或纤维化。如以肾小球系膜基质增多和基膜增厚为主,可致Ⅳ型胶原大量沉积(图1-43),还伴有Ln、Fn(图1-44)和一些蛋白聚糖的沉积等,在电镜下显示其为均质状电子透明样物,无纤维形成。而某些病变,如血管襻节段性硬化、渗出物机化、新月体纤维化和球囊壁破坏等病变则可引起肾小球纤维化,此时以Ⅰ、Ⅲ型胶原纤维沉积为主,在电镜下示其呈电子致密度较高的胶原纤维结构(图1-42)。此外,在病变的肾小球内,ECM成分及其组装也可发生极大的改变,如膜性肾炎的钉突部分的α(Ⅳ)多肽链,从α1(Ⅳ)、α2(Ⅳ)为主演变为以α3(Ⅳ)、α4(Ⅳ)为主;糖尿病肾小球硬化的GBM以α4(Ⅳ)为主;局灶节段性肾小球硬化症可见空泡化的足细胞显示活跃的α1(Ⅳ)mRNA的表达。又如前述,Ⅳ型胶原不同α链的结构与功能的改变,可能与某些肾脏疾病的发生有关,如肺出血肾炎综合征的发病与患者体内生成α3(Ⅳ)链的NC1相关的致病性抗体有关,而Alport综合征则是与α5(Ⅳ)链编码基因的突变有关,并导致GBM所含α5(Ⅳ)减少或缺失,进而造成GBM超微结构的异常改变。
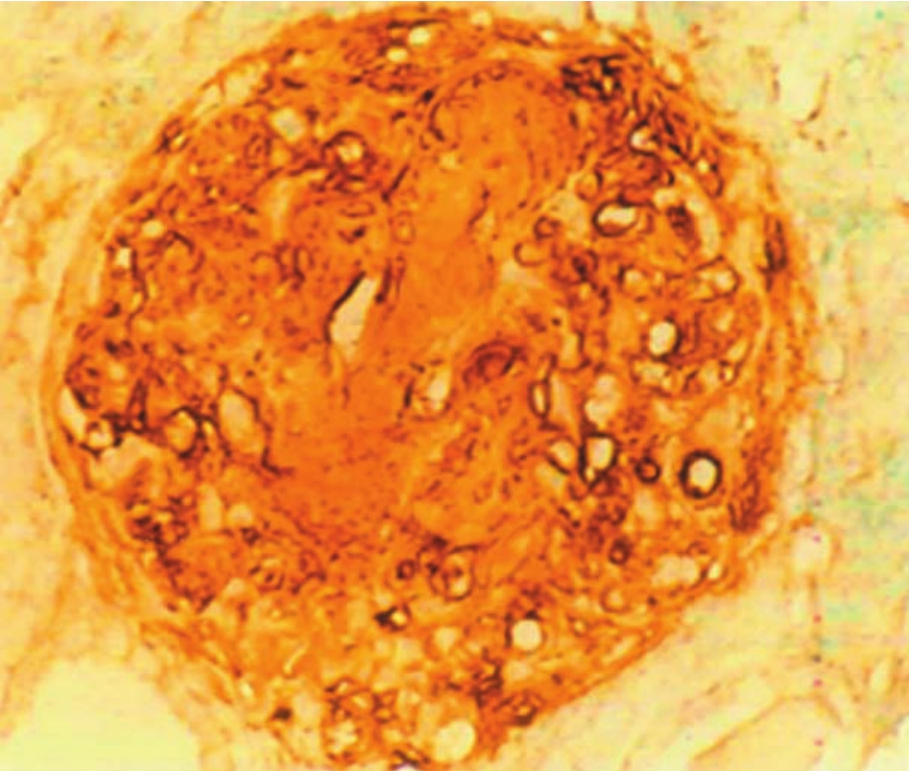
▲图1-43 硬化肾小球(IH ×400)
Ⅳ型胶原在硬化肾小球内大量沉积
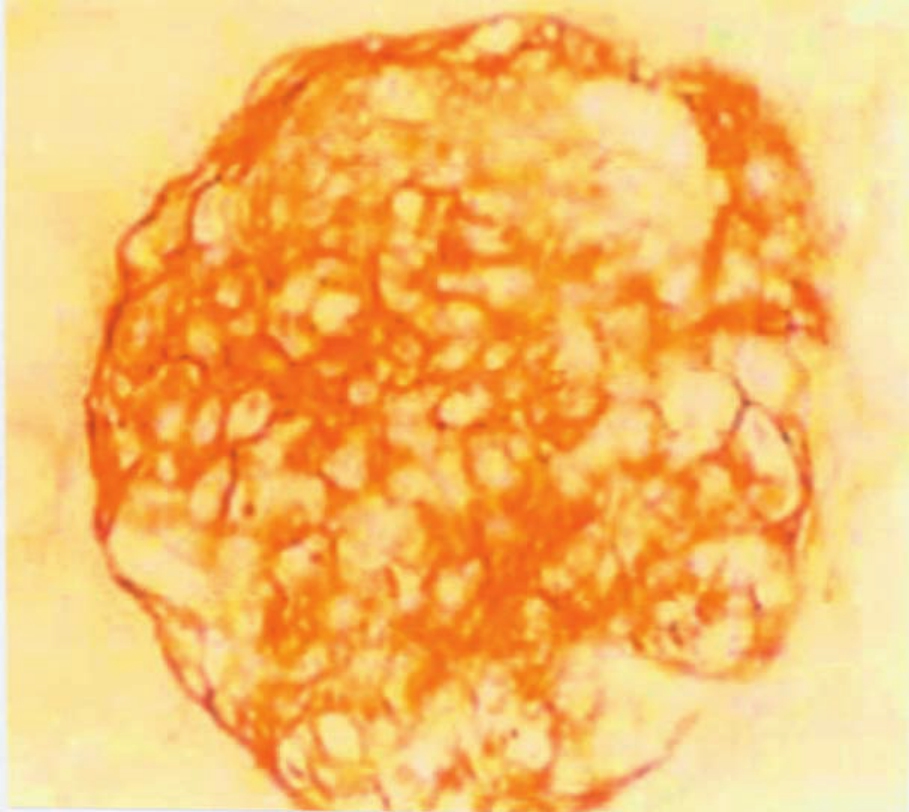
▲图1-44 硬化肾小球(IH ×400)
纤连蛋白在硬化肾小球内大量沉积
二、整合蛋白
整合蛋白(intergrin)是指一类存在于细胞表面、可参与细胞黏连的糖蛋白,也称为黏合受体(adhesion receptor)。它是由相对分子质量分别为120 000~200 000的α链和相对分子质量为80 000~120 000的β链构成的异型双聚体。α、β链均含有胞外、跨膜和胞质3个功能区(domain)。它们在不同的组织和细胞内形成不同的排列和组合,从而构成20多种或亚型的整合蛋白。目前研究表明,尽管整合蛋白也可参与细胞与细胞间的黏附作用,但它主要是介导细胞与ECM之间的黏合或相互作用。目前已知整合蛋白的胞外功能区,可以识别ECM的精-甘-天冬氨酸(RGD)三肽结构,后者可存在于Fn、Ln、玻连蛋白(Vn)和Ⅰ、Ⅳ型胶原等,而整合蛋白β链的胞质功能区则与细胞骨架蛋白、肌动蛋白、α-辅基动蛋白(α-actinin)、talin、纽带蛋白(vinculin)等相结合,从而参与和影响细胞的许多生理和病理过程,如胚胎发育、免疫反应、炎症反应、创伤愈合及肿瘤的浸润和转移。目前大量的实验研究已证实,在肾小球ECM大量沉积过程中,肾小球内多种细胞整合蛋白的表达均明显增强。
肾小球内3种固有细胞均可表达不同种类的整合蛋白,其中系膜细胞表达整合蛋白α5β1,内皮细胞表达α6β5及含αv的整合素,而肾小球上皮细胞则表达α3β1及αvβ3等,同时它们也均可表达与多数胶原结合的α1β1受体。实验证明,在进行性肾衰竭的先天性肾炎小鼠(ICR-derived glomerulonephritis mice)模型中,肾小球内各种亚基α1、α2、α5和β1的表达均明显增加,它与肾小球系膜区Ⅰ、Ⅲ型胶原和层连蛋白、腱蛋白的沉积密切相关。在人的各种增生性肾炎的病变中,肾小球系膜细胞的α1β1和α5β1表达均增强,并与肾小球内TGF-β水平升高相关,而后者则可进一步上调β1整合素的表达。在新月体肾炎中,也发现在肾小球足细胞中,其αvβ3表达增高,提示可能对新月体壁层上皮增生黏附有重要作用。在慢性硬化性肾炎中,硬化肾小球及纤维化间质中α5β1和αv整合素表达也显示明显增强。若将抗α1β1整合蛋白抗体,用于治疗大鼠Thy-1.1肾炎或新月体性肾炎时,则可减轻肾小球病变,如细胞增生和ECM的沉积等,同时其症状也获得一定改善。
三、细胞因子
大量实验证明,多种细胞因子(cytokine),如IL-1、PDGF、IGF、bFGF、EGF、TGF-β等,不管是外源性者,如来自炎症细胞(中性粒细胞、巨噬细胞等)或血小板,还是内源性者,即来自肾小球固有细胞,均可作用于肾小球细胞表面的相应受体而使其激活,并刺激肾小球细胞增生和基质合成。本节以TGF-β1、PDGF为代表,对其作一简单介绍。
(一)转化生长因子-β
转化生长因子-β(transforming growth factor-β,TGF-β)是一组具有多种功能的多肽,目前已知有5种不同分子亚型,即TGF-β1~TGF-β5。它们几乎存在于机体所有细胞内,在肾组织内主要有3种TGF-β,均可由肾小球固有细胞和肾小管上皮细胞分泌,尤以后者为多。目前研究发现,TGF-β3数量比TGF-β1少,TGF-β2则仅分布在肾小球球旁器。TGF-β1在合成初期是一个相对分子质量为25 000的双聚体的无活性分子,必须经过酶切和糖化,并与静态相关多肽(latent-associated peptide,LAP)或静态TGF-β结合蛋白(latent TGF-β-binding protein,LTBP)结合形成复合物,才能发挥其生理功能。当细胞受到一些刺激因素,如创伤、炎症、加热、放射线、酸、碱或蛋白酶等的作用,TGF-β可从连接蛋白中释放而被激活,再与细胞膜受体结合而发挥其作用。
实验证明,TGF-β在肾硬化的发生过程中起着非常重要的作用。TGF-β促进ECM合成和积聚主要有3个机制,包括:①TGF-β可直接增强肾小球固有细胞合成ECM。实验发现,TGF-β1可以刺激体外培养的鼠和人系膜细胞增强合成胶原(Ⅰ、Ⅲ、Ⅳ型)以及Fn、蛋白聚糖等表达。②通过促进纤溶酶原激活物抑制因子-1(PAI-1)和金属蛋白酶组织抑制因子(TIMP)等基质降解酶抑制因子的分泌,减少ECM的降解。③TGF-β可诱导ECM受体即整合蛋白在肾小球细胞表面的合成表达,促使细胞黏附于ECM,也有利于ECM成分的组装和合成,如腱生蛋白和Ⅰ型胶原的整合蛋白受体与相应配体结合后,则新合成的ECM蛋白能快速沉积在系膜区,如在大鼠抗Thy-1.1系膜增生性肾炎模型中证实,系膜基质中沉积大量ECM成分,如Fn、Ⅳ型胶原,并证明TGF-β1表达的增强和肾小球系膜区ECM沉积成正比,而注射抗TGF-β1中和抗体可明显减少其系膜细胞增生和基质增多。同样,Akagi等应用反义TGF-β1寡核苷酸,可减少肾小球TGF-β1 mRNA以及蛋白表达水平,也发现肾小球系膜区ECM沉积减少。相反,利用脂质体将TGF-β1cDNA经一侧肾动脉导入正常大鼠肾脏,该侧肾小球TGF-β1蛋白表达升高,并在1周内发生肾小球硬化,而对侧肾小球则维持正常。在人肾活检组织中,发现各种肾小球肾炎,包括IgA肾病、局灶节段性肾小球硬化症、新月体性肾炎、弥漫增生性狼疮性肾炎和糖尿病肾病中,肾小球内TGF-β1表达均显著增强,并与肾小球内ECM的增多和积聚密切相关。
(二)血小板源性生长因子
血小板源性生长因子(platelet-derived growth factor,PDGF)为一种富有阳离子的蛋白,相对分子质量约30 000,可分为A、B两链。肾组织内多种细胞,如肾小球系膜细胞、内皮细胞、上皮细胞和集合管细胞以及血管平滑肌细胞等均可产生PDGF。如在体外培养的系膜细胞中加入PDGF,能促进系膜细胞增生,同时也能引起Fn、Ⅳ型胶原mRNA及其蛋白表达的明显增高。应用原位杂交和免疫组化技术,均证实在系膜增生性肾炎、IgA肾病、狼疮性肾炎中,PDGF及其PDGF-β受体表达水平显著上调,而在非增生性肾炎,如微小病变病和膜性肾炎中,这些受体的表达基本保持正常水平。在动物实验中,Isaka等将PDGF的质粒注射入大鼠肾动脉,能诱导产生肾小球基质积聚、细胞增生,导致肾小球硬化。在大鼠抗Thy-1.1肾炎模型中,经PDGF抗体处理的大鼠,其肾小球系膜细胞增生和系膜区基质增多受到抑制,并减少巨噬细胞入侵。Floage等在肾大部分切除所致肾硬化大鼠中,证实PDGF表达增强以及由它引起的肾小球系膜细胞增生先于肾小球硬化的发生。由此表明,PDGF在肾小球硬化发生中的作用是显而易见的。
(三)其他因子
与肾小球硬化发生有关的其他细胞因子,如bFGF与肾小球上皮细胞损伤有关,如在大鼠膜性肾炎模型中,给予bFGF,大鼠的尿蛋白明显升高,可出现肾小球上皮细胞足突融合、囊性化及脱失等改变,肾小球硬化程度明显加重。胰岛素样生长因子-1(IGF-1)也可通过系膜细胞表面IGF受体而促使其分裂,且其Ⅰ、Ⅲ型胶原合成也增多。生长激素(GH)转基因小鼠则出现肾小球体积增大伴快速进展的肾小球硬化。此外,结缔组织生长因子、血管紧张素Ⅱ、内皮血管肽、一氧化氮等,都能通过各种不同机制影响肾小球ECM的代谢,而促进ECM在肾小球内的沉积。
除上述细胞因子可促进肾小球固有细胞增生和基质合成外,在体外实验中还发现另一些成分或因子,可抑制肾小球固有细胞(如系膜细胞)的分裂,包括cAMP、心房利钠肽(arterial natriuretic peptide,ANP)、肝素(heparin)、高浓度TGF-β、肾上腺髓质素、PGIα-PGF2α-TXA2等。这些因子在体内的相互作用及其信号途径间的“串话”(cross-talk),更像一个复杂的网络。要清楚它们之间的相互关系,有待进一步深入细致的研究。
四、基质降解酶系统
基质降解酶系统(matrix degradation enzyme system)是指一类参与ECM代谢的蛋白酶及其抑制物,目前最令人关注、且已证实与肾小球硬化关系密切的是纤溶酶原激活物及其抑制因子(PA/PAI)和基质金属蛋白酶及其组织抑制因子(MMP/TIMP)两大酶系统。
(一)纤溶酶原激活物/纤溶酶原激活物抑制因子
纤溶酶原激活物(plasminogen activator,PA)及其抑制因子(plasminogen activator inhibitor,PAI)是介导肾小球ECM代谢重要的降解酶系统之一。前者可分为组织型(tissue PA,t-PA)和尿激酶型(urokinase PA,u-PA)两种;而后者则可分为4种,分别简称为PAI-1、PAI-2、PAI-3和PAI-4。PAI可与PA发生特异性结合而使PA丧失活性。PA的功能是催化纤溶酶原转变为纤溶酶,后者不仅可降解纤维蛋白(Fb)、Fn等成分,而且还可激活MMP,发生PA-纤溶酶-MMP瀑布式放大效应,加剧对ECM的降解,损害和破坏肾小球的正常结构,引起肾小球炎症反应,并进一步反馈性促进组织内PAI,尤其是PAI-1的分泌和活性增强,从而抑制PA活性,促进ECM合成增加和积聚,最终导致肾小球硬化。
目前大量研究表明,PA/PAI酶系统在肾组织内的分布十分广泛,PA主要由肾小球和肾小管上皮细胞分泌,也可由激活的肾小球系膜细胞合成和分泌;而PAI-1在人体内的分布更为广泛,肾小球固有细胞也均可合成PAI-1。国外一些作者在人的各种增生性肾炎(如IgA肾病、狼疮性肾炎等)病例中,证实病变肾小球的t-PA表达增强,我组也曾应用免疫组化法,证实在肾活检组织中,不仅有u-PA的表达增强,同时还伴有PAI-1的高表达,且后者的表达与肾小球Ⅳ型胶原的沉积呈正相关。也有许多实验证明,PA/PAI系统表达的改变可受许多因素,尤其是细胞因子的影响,曾有学者在体外实验中证实,IL-1可刺激肾小球系膜细胞和上皮细胞分泌t-PA。其他被证实的细胞因子,还有TNF-α、TGF-β1等。
(二)基质金属蛋白酶/基质金属蛋白酶组织抑制因子
基质金属蛋白酶(matrix metalloproleinase,MMP)及其组织抑制因子(tissue inhibitor of matrix metalloproteinase,TIMP)是介导肾小球ECM代谢的另一对重要的降解酶系统。前者主要分3类:①间质胶原酶,如MMP-1、MMP-5,主要降解Ⅰ型和Ⅲ型胶原;②明胶酶,包括MMP-2、MMP-9,主要降解Ⅳ型、Ⅴ型胶原;③间质溶解素,如MMP-3、MMP-10及基质水解蛋白等,主要作用于ECM成分的糖蛋白,如Fn、Ln等。TIMP也有3种,并分别称为TIMP-1、TIMP-2、TIMP-3。TIMP也可与MMP发生特异性结合而使MMP丧失活性。
实验研究表明,在肾小球损伤或炎症过程中,无论是浸润的炎症细胞,还是增生的系膜细胞和上皮细胞均可产生各种细胞因子,如IL-1、TGF-β1、PDGF、TNF-α等,且均可通过影响肾小球内MMP/TIMP系统的表达,而促进ECM在肾小球的合成和沉积。有作者报道经IL-1作用的大鼠系膜细胞,其MMP-3 mRNA、蛋白及酶活性明显增强,并且TIMP-1也有轻度增高。而在人系膜细胞和上皮细胞中,则可促进MMP-2、MMP-3和MMP-9 mRNA表达及其酶活性的增强,还伴有TIMP-1和TIMP-2的表达增强。也有作者在大鼠Thy-1.1肾炎模型中,发现TGF-β1的表达增强与肾小球中MMP-2 mRNA表达增加及细胞增生等改变密切相关。
参与肾小球ECM代谢或ECM成分降解的酶系统还有多种,如来自中性粒细胞的中性蛋白酶(包括蛋白酶-3)、单核细胞的弹性蛋白酶、阳离子蛋白等。总之,以ECM沉积为特征的肾小球硬化的发生,是基质降解酶活性被抑制及ECM不断沉积的最终结果。
五、细胞信号转导通路
细胞信号转导通路(cellular signal transduction pathway)是近年来生命科学研究的一个热点。随着对肾小球固有细胞,尤其是系膜细胞和上皮细胞以及其他各种间叶细胞,如成纤维细胞、血管平滑肌细胞的研究进展,无论在确定作用于细胞表面各种受体的配体,还是当其受体激活后细胞内所发生的生化改变及其信号转导通路的研究均取得了重大进展。目前在系膜细胞已被证实的细胞内信号转导通路主要有下列几种。
(一)经腺苷环化酶作用生成cAMP途径
激活的受体通过GTP结合蛋白(简称G蛋白)而与腺苷环化酶结合,将其核苷酸ATP转化生成cAMP,后者依次激活蛋白激酶A(PKA)或蛋白激酶C(PKC),继而形成激活的磷酸化蛋白,再催化作用于核内酶运输结构或调节结合受体,从而结合于DNA反应成分,调节细胞分裂和基因的表达。属于这类途径的配体有组胺、异丙肾上腺素、多巴胺、前列腺素(PGE2、PGI2)等,它们可影响细胞增生、收缩活动和红细胞生成素的释放等过程。
(二)经鸟苷环化酶作用生成cGMP途径
激活的受体通过鸟苷环化酶作用生成的cGMP作用于蛋白激酶G(PKG),该酶广泛分布于肾内血管收缩功能的细胞,如肾小球系膜细胞、血管平滑肌细胞、微血管周细胞和肾间质成纤维细胞。属于这条途径者是心房利钠肽(ANP),后者的作用是抑制血管紧张素Ⅱ诱导的系膜细胞收缩作用,从而出现强烈的缩血管效应。
(三)经磷脂酶C和A2生成三磷酸肌醇(IP3)和二酰甘油(DAG)途径
此途径是系膜细胞受体激活后所发生的一种常见的信号系统。当其受体被激活后可导致G蛋白-磷脂酶的激活,从而生成IP3和DAG。前者可动员细胞内Ca2 +,致胞质内Ca2 +升高;后者可激活PKC。已知PKC有12种亚基,分为3类,即常规型、新型和非典型PKC。它们单独或协同地控制细胞内许多种靶蛋白酶的活性,后者参与DNA的转录过程及其基因表达,影响细胞的生理活动。属于这一途径者有缓激肽、去甲肾上腺素、凝血酶、5-羟色胺、PDGF、血小板活化因子(PAF)、前列腺素等。近来又发现TGF-β、生长激素、高葡萄糖、血管紧张素、血凝素、凝血因子和补体等,也均可通过该途径而促进肾小球系膜细胞增生,从而在肾小球硬化发生中扮演重要角色。
(四)TGF-β-Smads信号转导通路
近年来通过大量实验表明,TGF-β-Smads信号转导通路是参与肾小球硬化和肾间质纤维化发生的重要信号通路。Smads家族是TGF-β在与其细胞表面相应受体(TβR)结合后所生成的主要信号转导分子。可分为3类:①通路限制性Smads,包括Smad 1、Smad 2、Smad 3和Smad 5;②共同介导性Smad,即Smad 4;③抑制性Smads,包括Smad 6、Smad 7。其转导过程:TGF-β配体首先结合于细胞表面的TGF-βⅠ、TGF-βⅡ型受体,继而启动Smads系统,Smad 2、Smad 3首先被磷酸化形成复合物,再连接Smad 4形成四聚体,后者被转移至细胞核内,再经核内一些转录因子作用,而调节TGF-β的靶基因,如α1(I型)胶原、PAI-1及JunB等。而Smad 6、Smad 7则对上述转导过程发生负反馈抑制作用。笔者最近通过对培养的大鼠系膜细胞的实验研究证实,该信号转导通路中的Smad 2、Smad 3和Smad 4也参与了系膜细胞Ⅰ、Ⅲ、Ⅳ型胶原和Fn合成、分泌,而Smad 7则对其起抑制作用,表明TGF-β-Smad信号转导通路在肾小球硬化发生机制中起着重要作用。
(五)丝裂原激活蛋白激酶信号转导通路
实验证实,丝裂原激活蛋白激酶(mitogen activated protein kinase,MAPK)在正常细胞中,参与其生长、发育、分裂及细胞间的功能同步等多种生理过程,然而目前已知其可介导ECM代谢,其通路有3条:①ERK通路(细胞外信号调节激酶);②JNK通路(c-Jun NH2-末端激酶);③P38通路(P38 MAP激酶)。其激活有着共同的特点,即都经过一个蛋白激酶的级联激活系统:刺激因子→MAPKKK→MAPKK→MAPK,其中MAPKKK和MAPK都属Ser/Thr蛋白激酶,而MAPKK,则既能磷酸化Ser/Thr,又能磷酸化Tyr。上述激酶可被许多细胞因子激活,如高糖培养液中的系膜细胞,其ERK-MAPK被激活,活性ERK能进一步激活三聚复合物因子EIK-1,从而增强核因子c-fos和c-jun的表达,促进AP-1与DNA结合。而TGF-β启动子中存在多个与AP-1相似的结合位点,当其受到PKC等作用后,可增强AP-1与TGF-β启动子结合,从而促进Ⅰ型胶原和Fn的合成。此外,在糖尿病肾病发病中起作用的其他因素,如肾小球高血压、氧化物刺激、非酶性糖基化物及其他因子,均可能与该通路有关。在培养的系膜细胞中,还证实机械张力、血管紧张素Ⅱ、内皮血管肽、肾上腺髓质素、TGF-β1及进展性糖化合物终末产物等都能激活ERK,同时P38-MAPR通路也受许多上述因素所影响。
然而,上述不同的信号转导通路,在肾小球硬化发生中所起的作用并不是孤立存在的,而是相互联系和密切相关的,常可在细胞内形成一个相互交叉、关联的作用网络。就以TGF-β1对肾小球系膜细胞作用为例,在激活其受体(Tβ-R)后所涉及的信号通路,不仅是Smad通路,还包括PKA、蛋白激酶Ⅱ、MAPK等通路。即使在不同的信号转导通路间也存在着“串话”,这对人们的深入研究提出了更大的挑战。我们相信,随着科学技术的不断发展,尤其是近代系统发生学和生物信息学研究所取得的新进展,已为肾小球硬化发生机制的深入研究提供了更深入、更完整的理论基础,对其本质的阐明是一件指日可待之事。
(本节由张志刚编著)
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















