第二节 肾炎的发病机制及肾小球炎症的基本病变
肾小球肾炎(glomerulonephritis,GN)简称肾炎(nephritis),它是一种以肾小球损害为主的超敏反应性疾病,其中大多数是由抗原抗体复合物所引起。在临床上将其分为两大类:一类为原发性肾小球肾炎(primary GN),即单独发生于肾小球的疾病,其病因大多不明;另一类为继发性肾小球肾炎(secondary GN),即继发于其他疾病的肾小球疾病,如狼疮性肾炎、紫癜性肾炎、系统性血管炎等。
一、肾炎的病因和发病机制
肾炎的病因多数未明。然而,一个多世纪以来,通过对各种实验性肾炎动物模型的复制,以及近50年来对人类肾炎患者肾穿刺活检组织的免疫病理学检查和电镜观察,证明肾炎中的大多数是由免疫复合物介导的一种免疫性损伤(即原发机制),同时也伴有复杂的非免疫性损伤(即继发机制),后者包括细胞机制、补体、激肽和凝血机制等。本节着重介绍其免疫机制和细胞机制。
(一)肾小球损伤的免疫机制
目前,根据肾炎的免疫发病机制,主要分为以下两种类型。
1.循环免疫复合物性肾炎(circulating immune complex nephritis)确定肾炎的发病与体内循环免疫复合物有关的研究,可以追溯到20世纪初。1911年,von Pirquest等应用外源性异种动物血清(如牛血清),首次成功地复制了家兔血清病(serum sickness),这是一种由异种动物血清所致的免疫复合物病。至1913年,Longcope等又发现患有血清病家兔的肾小球出现类似肾炎的病理改变,如肾小球细胞的增生和肿胀,而在注射异种蛋白的某些豚鼠发现有新月体形成的肾炎,由此首先提出了肾炎的发病是由循环免疫复合物所致的观点。在以后的研究中,不仅越来越多的学者赞同和支持这一观点,还逐渐将其分为急性、慢性和被动性血清病性肾炎3类。
(1)急性血清病性肾炎(acute serum sickness nephritis)通常是因一次大剂量注射异种动物血清所致。1948年,Rich和Gregoty等又分别将用于临床的异种动物血清换成异种清蛋白、卵蛋白等进行注射,结果也同样成功复制了家兔弥漫性增生性肾炎。至1950年,Germuth和Dixon等证实应用牛血清清蛋白诱导家兔等动物的血清病,并证实其动物体内抗原消失、抗牛血清蛋白抗体形成、补体水平下降和动物肾小球病变发生之间的相互关系,并提出循环免疫复合物和免疫复合物性肾炎(immune complex nephritis)的概念。与此同时,还证明先前首次注射过该抗原的家兔,若再注射同种抗原时,其免疫复合物形成和肾炎的发生可提前,并称其为加速性肾炎。至1968年,由Dixon首先提出了免疫复合物型和抗肾小球基膜型两种免疫发病机制致肾炎的分类法,这一提法曾被后来学者沿用30余年之久。
(2)慢性血清病性肾炎(chronic sickness nephritis)自先前建立了急性血清病性肾炎后的多年后,许多学者又不断通过对注射剂量、时间和抗原种类的改变,先后复制成各种动物,如家兔、羊、牛等慢性血清病性肾炎,并发现其肾小球病变性质呈多样化,且程度不一,其病理表现可自肾小球轻微病变、基膜增厚、细胞增生伴血管襻坏死、新月体形成等,从而证实了循环免疫复合物可使人类出现不同组织病理学类型肾炎的事实。
(3)被动性血清病性肾炎即将体外制成的各种致肾炎免疫复合物直接注入动物模型体内,同样也成功地建立了各种肾炎动物模型,并称其为被动性血清病性肾炎(passive serum sickness nephritis)。这不仅更加确立了免疫复合物可致肾炎的观点,还从病理上再次证实其肾炎与人类各种不同类型肾炎病变的相似性。这类由可溶性抗原引起的急性血清病性肾炎,其肾组织的光镜、免疫荧光和电镜检查结果均与人的感染后肾炎(或称弥漫性增生性肾炎)、狼疮性肾炎、冷球蛋白血症肾炎的形态特征均十分相似。目前,根据致病抗原来源不同,大致可分为两大类:①外源性抗原,如细菌,包括A群乙型溶血性链球菌、葡萄球菌、伤寒杆菌、白喉杆菌等;病毒,如乙型肝炎、丙型肝炎、麻疹、水痘和腮腺炎病毒;寄生虫,包括三日疟、血吸虫和包囊虫;真菌,如球孢子菌、白念珠菌;立克次体和螺旋体等。其他还有药物、毒素和动物血清等。②内源性抗原,包括巨球蛋白、甲状腺球蛋白、癌胚抗原等。循环免疫复合物性肾炎可用免疫荧光法显示其沉积物呈颗粒状免疫荧光(图1-29),沿肾小球毛细血管襻排列和(或)沉积于系膜区。电镜可发现其电子致密物的沉积,通常有系膜、内皮下、上皮下区和膜内沉积4种类型。
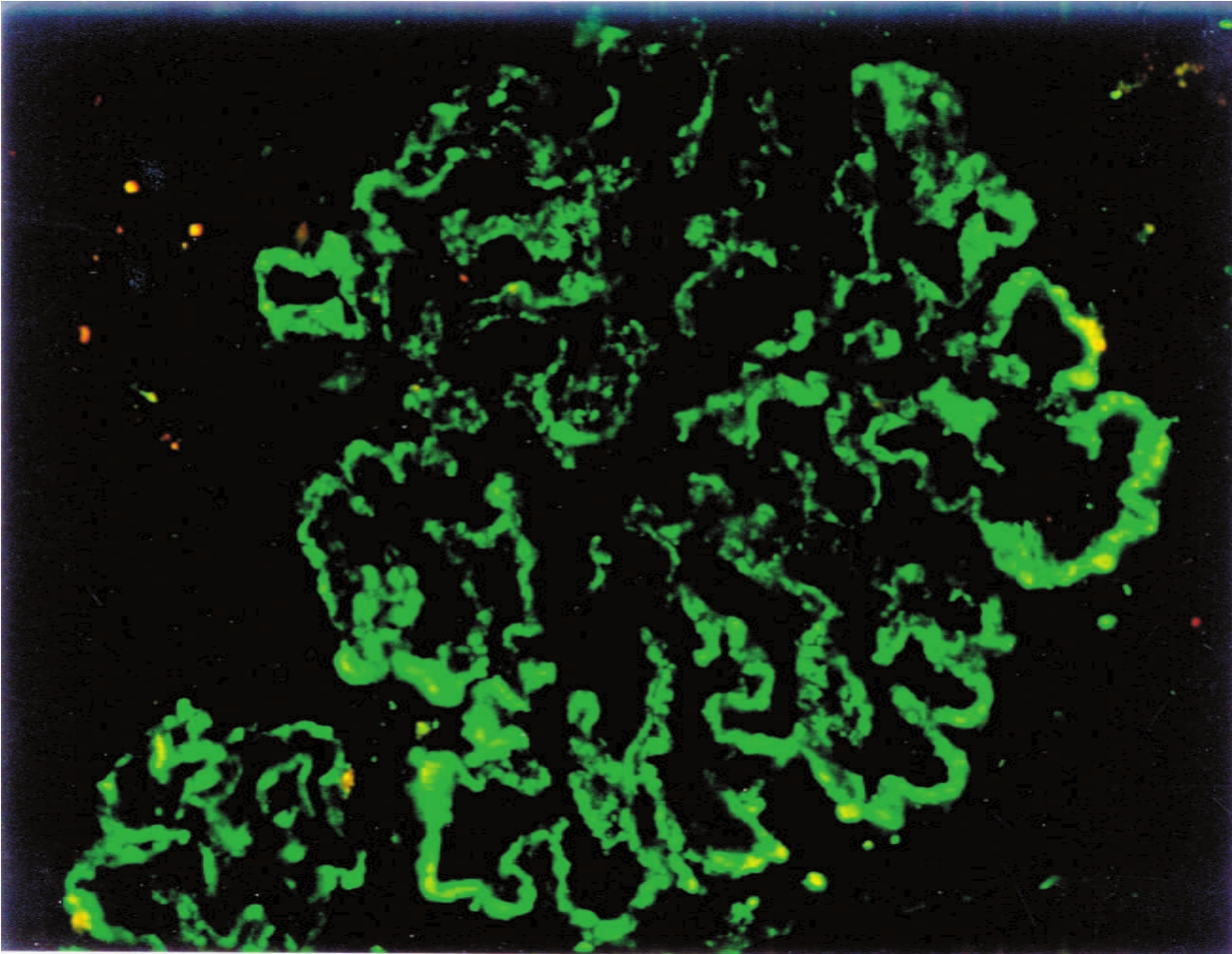
▲图1-29 颗粒状免疫荧光(MGN)(IF ×400)
呈颗粒状排列的IgG沿肾小球血管襻分布
2.原位免疫复合物型肾炎(immune complex nephritis in situ)对于肾组织自身结构抗原可致肾炎的认识,也许更早于对循环免疫复合物性肾炎的了解。早在1900年,Lindeman等就采用注射异种动物抗肾血清的办法,观察到被注射动物可发生蛋白尿和尿毒症等症状。据目前文献报道,已被确定者有以下3类。
1)肾小球基膜成分有以下3类。
(1)肾毒血清性肾炎又称Masugi肾炎。在20世纪30年代由Masugi和50年代Krakower和Greenspon等,先后在大鼠、家兔中,重复发现肾源性抗血清可致肾炎的结果,且发现其抗原沿着GBM分布。近20余年来,又有许多作者采用同样方法,可在绵羊、狗和豚鼠等复制出肾炎模型,而且还发现由不同器官基膜抗原,同样可致动物抗GBM抗体的形成和肾炎的发生。近年来,许多作者又采用不同GBM组分致膜性肾炎的研究,其中包括Ⅳ型胶原(ColⅣ)、层连蛋白(Ln)、硫酸乙酰肝素蛋白聚糖核心蛋白以及Ⅳ型胶原NC1抗血清等,但至今还未复制出与人类肺出血-肾炎综合征(Goodpasture syndrome)极为相似的肾炎模型。
与肾毒血清性肾炎表现相似的人类疾病,是肺出血-肾炎综合征,即抗肾小球基膜型肾炎。它远较免疫复合物型肾炎少见,仅占5%的病例。其抗原为肾小球基膜中所含的不溶性蛋白,目前已证实其为α3(Ⅳ)链的非胶原性功能域,即NC1。绝大多数患者的血清中可发现抗该抗原的抗体。然而目前对于其抗体生成的原因尚不清楚。该抗体除可作用于肾小球基膜本身而形成原位免疫复合物外,还可与肺泡壁毛细血管基膜中相似成分相结合,引起肺部毛细血管的免疫性损伤而发生肺出血,故称肺出血肾炎综合征。目前又将引起该病的α3(Ⅳ)的NC1抗原称为Goodpasture抗原。抗肾小球基膜性肾炎的肾组织,可经免疫荧光法显示GBM有免疫球蛋白和补体沉积,呈连续的线状排列(图1-30)。电镜下一般不表现为电子致密物沉积。
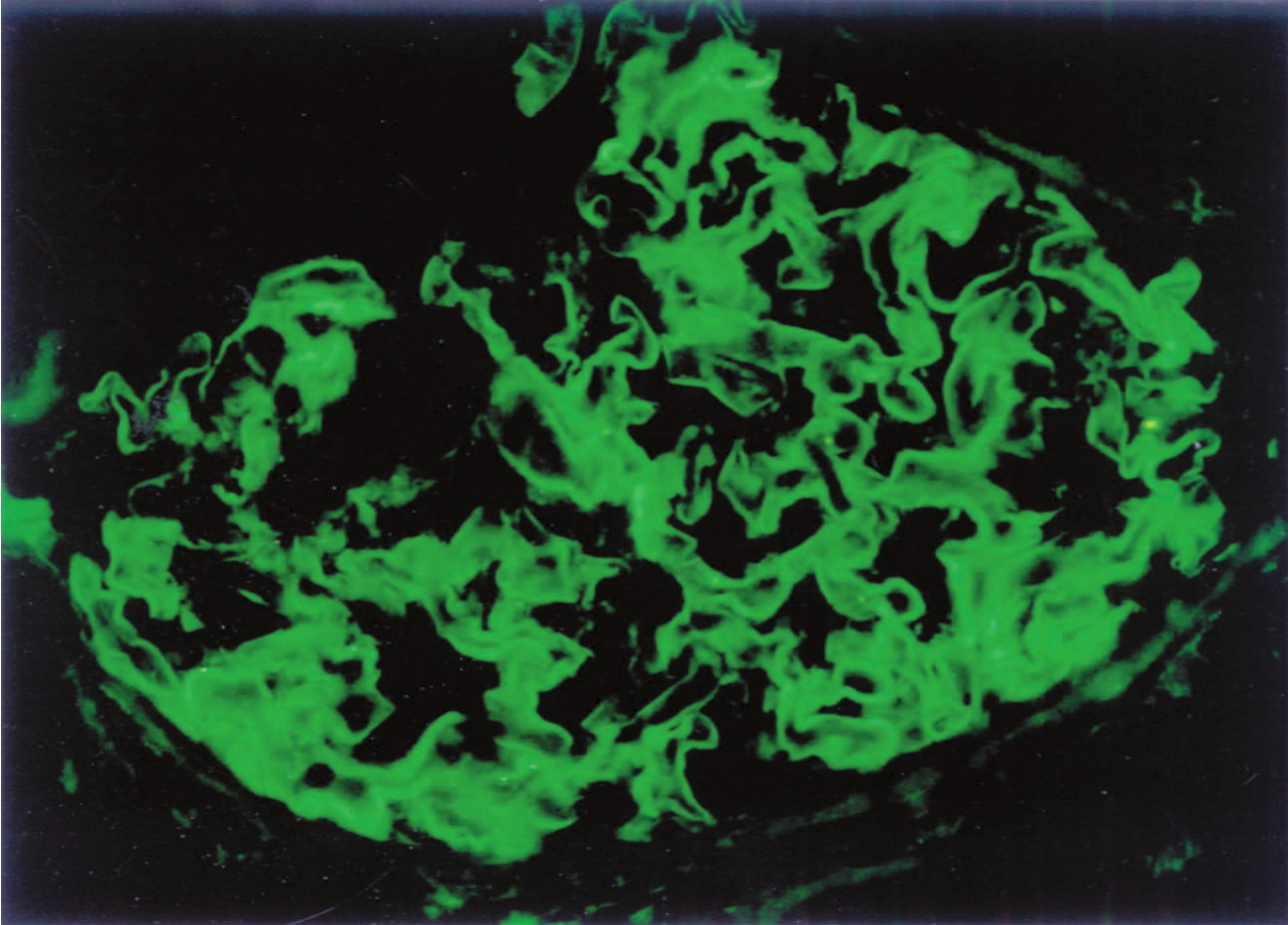
▲图1-30 线状免疫荧光(抗GBM病)(IF ×400)
呈线状排列的IgG沿肾小球血管襻分布
(2)自身免疫性肾炎1962年,首先由Stablay使用人GBM伴弗氏佐剂的方法,复制成功绵羊的新月体性肾炎,并采用免疫荧光技术证实其IgG在肾小球内的沉积呈线状分布,后将其循环抗体注入其他绵羊,发现后者肾内的抗体主要与肾小球Ⅳ型胶原的NC1发生结合。此后,又有其他作者采用人肺基膜加用弗氏佐剂免疫动物,可致猴、狗、兔和大鼠发生新月体性肾炎。也有作者采用异常GBM制剂,复制了多种动物的肾炎。而另一些作者进一步将其NC1制剂主动免疫羊,可引起羊的肾炎,而使用纤连蛋白(Fn)、层连蛋白(Ln)等制剂,均未引起动物模型的蛋白尿,从而确立了NC1可能是人抗基膜性肾炎的致炎性抗原。
(3)氯化汞引起的肾炎20世纪60年代,一些作者采用慢性注射氯化汞的方法(2mg/kg,每周2次,共3周),可在家兔或挪威大鼠复制肾炎的报道。注射后初期,动物血清中出现抗GBM抗体,免疫荧光检查证实IgG沿GBM、TBM呈线状沉积,其范围较肾毒血清性肾炎更广泛,而且还发现其沉积可分布于其他器官的基膜。而在注射后期,在对挪威大鼠模型血清和肾组织中,分别检测到含IgG、C3成分的免疫复合物的存在。由此可见,由氯化汞所引起的肾炎,可涉及抗GBM型和免疫复合物型(呈双相反应)的两种发病机制。
2)肾小球细胞抗原主要有下列3种。
(1)Heymann肾炎(Heymann nephritis)又称抗上皮细胞性肾炎。于1959年,首先由Heymann报道。该作者发现经注射同源性肾组织提取物可致大鼠出现蛋白尿的现象,其肾组织经免疫荧光技术发现IgG呈颗粒状分布于肾小球上皮下区,与人类膜性肾炎的检查结果十分相似。后经生化测定,证实其抗原为gp330(即Fx1A,megalin),为肾近端小管上皮细胞刷状缘的成分,也可表达于肾小球脏层上皮细胞。此后,又有作者发现其gp600大分子物及其gp330的相对分子质量95 000~108 000的糖蛋白成分也可引起动物的肾炎,从而进一步确定其致病性。尽管Heymann肾炎的抗原在人类大多数膜性肾炎病例中未被检测到,但推测其致病方式在人类的肾炎中也可能是同样存在的。
(2)Thy-1.1系膜增生性肾炎又称抗系膜细胞性肾炎。20世纪80年代,一些作者经免疫荧光、电镜检查证实,肾小球系膜细胞表面存在丰富的大鼠胸腺细胞分化抗原(Thy-1.1抗原),故采用分离大鼠胸腺细胞,免疫家兔,制得兔抗大鼠Thy-1.1抗血清,再将其注入大鼠体内,成功地复制了大鼠Thy-1.1系膜增生性肾炎模型。Floege等观察到在其抗血清单次注射3~5d后,肾小球系膜细胞增生明显,α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)和增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)呈阳性表达。以后又有作者应用其单克隆抗体,也同样复制出大鼠系膜增生性肾炎模型。然而实验证明,这种肾炎的过程呈自限性。
(3)抗内皮细胞性肾炎1981年,Matsuo报道了给予家兔异种抗血管紧张素转换酶抗体,可致动物轻度短暂的肾炎。约8 d后,家兔可出现自身抗体在肾小球内的沉积,其部位是肾小球内皮细胞,还伴有内皮细胞肿胀、中性粒细胞和巨噬细胞浸润及血小板增多的改变。最近有作者在IgA肾病、狼疮性肾炎、系统性血管炎和血栓性微血管病患者中,也检测到循环的抗内皮细胞抗体,但对其在人类肾炎发病中的意义尚待研究。
3)植入抗原外源性植入抗原的种类很多,除引起肾毒血清性肾炎的异种抗GBM血清外,还有人IgG、各种阳离子蛋白(如转铁蛋白、清蛋白、球蛋白)、DNA、细菌产物等,由其引起的肾炎可表现为系膜增生型肾炎、膜性肾炎等。对该类肾炎病例的肾组织免疫荧光和电镜检查结果则与循环免疫复合物型基本相同。
(二)肾小球损伤的细胞机制
如前所述,已知大多数肾小球肾炎是因免疫反应异常所致。然而近20年来,由于可标记细胞来源的单克隆抗体的大量使用,对其依赖T细胞所发生的细胞免疫机制、血液来源的炎细胞以及肾小球固有细胞,在引起肾小球损伤中的作用越来越为人们所认识,而且取得了许多研究进展。
1.T细胞1978年,Bhan报道T细胞介导肾小球损伤。他在实验中发现,如同时给予同种动物致敏淋巴细胞和少量抗原或亚剂量抗GBM血清,实验动物就可发生以肾小球细胞增生和毛细血管襻坏死为特征的肾小球病变。以后又有作者在禽类肾小球肾炎模型中发现,肾小球损伤也可在缺少抗体形成或补体参与的情况下,直接由细胞免疫异常引起。许多作者还在加速性肾毒血清性肾炎的实验中证实,输入的致敏淋巴细胞进入肾小球要早于来自血液的单核细胞,而且还认为T淋巴细胞所释放的淋巴因子(如巨噬细胞移动抑制因子),可促进单核细胞在肾小球内的聚集或浸润。近年来研究又证实,受MHC-Ⅰ类抗原限制的细胞毒性T细胞,可直接介导对肾小球内皮细胞的损伤作用。由此可见,淋巴细胞的致敏、细胞因子的释放和直接溶解作用,也是造成肾小球损伤的重要机制之一。
2.血源性细胞一直为人们所关注的主要是中性粒细胞、单核细胞和血小板,且在人类肾病患者的肾活检组织中得到证实(图1-31)。近年来,大量的实验研究证实,中性粒细胞释放的中性蛋白酶,生成的H2O2以及超氧离子等自由基均是破坏肾组织的重要介质。出现于肾小球内的单核细胞,究竟是起损伤作用还是修复作用,曾一度成为各国学者争论的焦点。近年来,发现其产生大量的活性(或潜在活性)物质,如胶原酶、弹力酶、阳离子蛋白、氧自由基、前列腺素、血小板活化因子(PAF)等,均可造成对肾小球的损伤。血小板对肾小球的损伤作用,早在30多年前已为大家所接受,然而其机制一直未能阐明,近年来最令人感兴趣的是PAF,后者不仅是炎症细胞的趋化因子,也可直接损伤GBM,增加肾小球滤过膜的通透性,由其释放的其他物质,还有阳离子蛋白、血小板第4因子、前列腺烷(prostanoids)、凝血烷或血栓烷A2(thromboxane A2,TXA2)、类肝素酶(heparatinase)等,均可对肾小球有损伤作用。
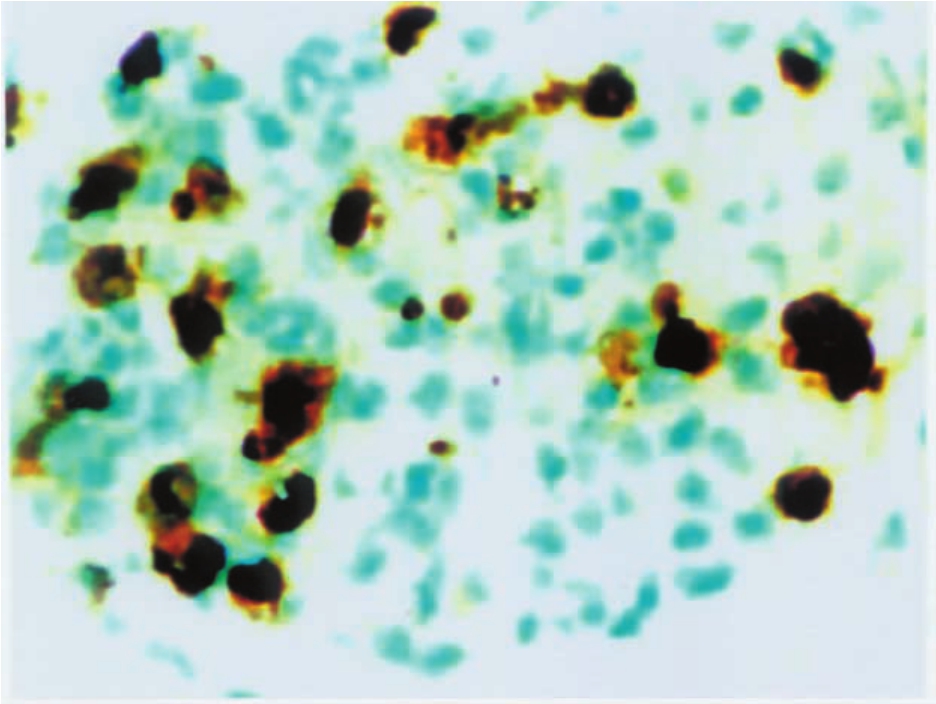
▲图1-31 肾小球内炎症细胞(IH ×400)
肾小球内有多个表达MAC-387抗原的炎症细胞浸润
3.肾小球固有细胞包括肾小球上皮细胞、系膜细胞和内皮细胞。多年来人们一直认为,它们是肾小球发生免疫性损伤的受害者。然而近年来,由于体外培养的各种肾小球细胞株的建立,发现在它们遭受损伤的同时,也可通过细胞间的旁分泌和自分泌参与或调节发生在肾小球的免疫性损伤。体外培养的肾小球上皮细胞可生成相对分子质量分别为72 000和92 000的基质金属蛋白酶(明胶酶),而在被动性Heymann肾炎动物模型体内,则被证实为相对分子质量为98 000的中性蛋白酶,其作用极相似于基质金属蛋白酶-9(MMP-9)。同时在实验中,还发现其能降解Ⅰ型和Ⅳ型胶原及纤连蛋白(Fn),且与实验动物发生蛋白尿密切有关。除此之外,上皮细胞还可合成和分泌白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)、补体C3以及通过合成和分泌纤溶酶原激活物,而加速生成的纤溶酶和细胞表面存在的C3b受体以及IgG的Fc片段等因素,均与肾小球损伤有着密切的关系。具有血管平滑肌样细胞特性的肾小球系膜细胞,可通过收缩功能而调节许多血液中大分子物质(包括免疫球蛋白)在肾小球系膜区的沉积;通过自分泌机制分泌白细胞介素-1(IL-1)、血小板源性生长因子(PDGF)、前列腺烷类、各种蛋白降解酶及超氧离子等,加剧肾小球的炎症反应。肾小球内皮细胞通过其表面黏附分子,如血管细胞黏附分子-1(VCAM-1)、细胞间黏附分子-1(ICAM-1)的表达增强及释放血小板活化因子(PAF)、PDGF等细胞因子也促进发生肾小球的炎症过程。
二、肾小球炎症的基本病变
肾小球肾炎因其致肾炎抗原和机体反应性的不同,其形态表现复杂而多样。病变可呈急性或慢性经过;急性者仅为几周,慢性者可长达数十年。病变程度有轻有重:轻者光镜显示无明显病变,重者可发生毛细血管襻纤维蛋白样坏死、新月体形成和肾小球硬化等;病变可广泛弥漫(diffuse),累及两肾几乎全部肾小球,或呈局灶性(focal),即仅有部分肾小球受累。以单个肾小球而言,如病变累及整个肾小球者,称为球性(global)分布;仅一个或几个小叶受累者,称节段性(segmental)病变。现将肾小球损伤的基本病变概述如下。
(一)细胞增多
细胞增多(hypercellularity)常指肾小球内有核细胞,包括肾小球固有细胞(即内皮细胞、系膜细胞和上皮细胞)以及随血流而来的细胞,如中性粒细胞、淋巴细胞和单核细胞数的增多。在厚约3 μm的肾组织切片中,一个正常肾小球内的有核细胞数为100 ±20个,炎症细胞数不超过4个,如超过者可视为肾小球细胞数增多和炎症(图1-32)。肾小球固有细胞数的增多称为增生,其中内皮细胞、系膜细胞增生称为毛细血管内增生(endocapillary proliferation);而球囊壁层上皮细胞增生则称为毛细血管外增生(extracapillary proliferation)。而白细胞的增多称为滞留或浸润。
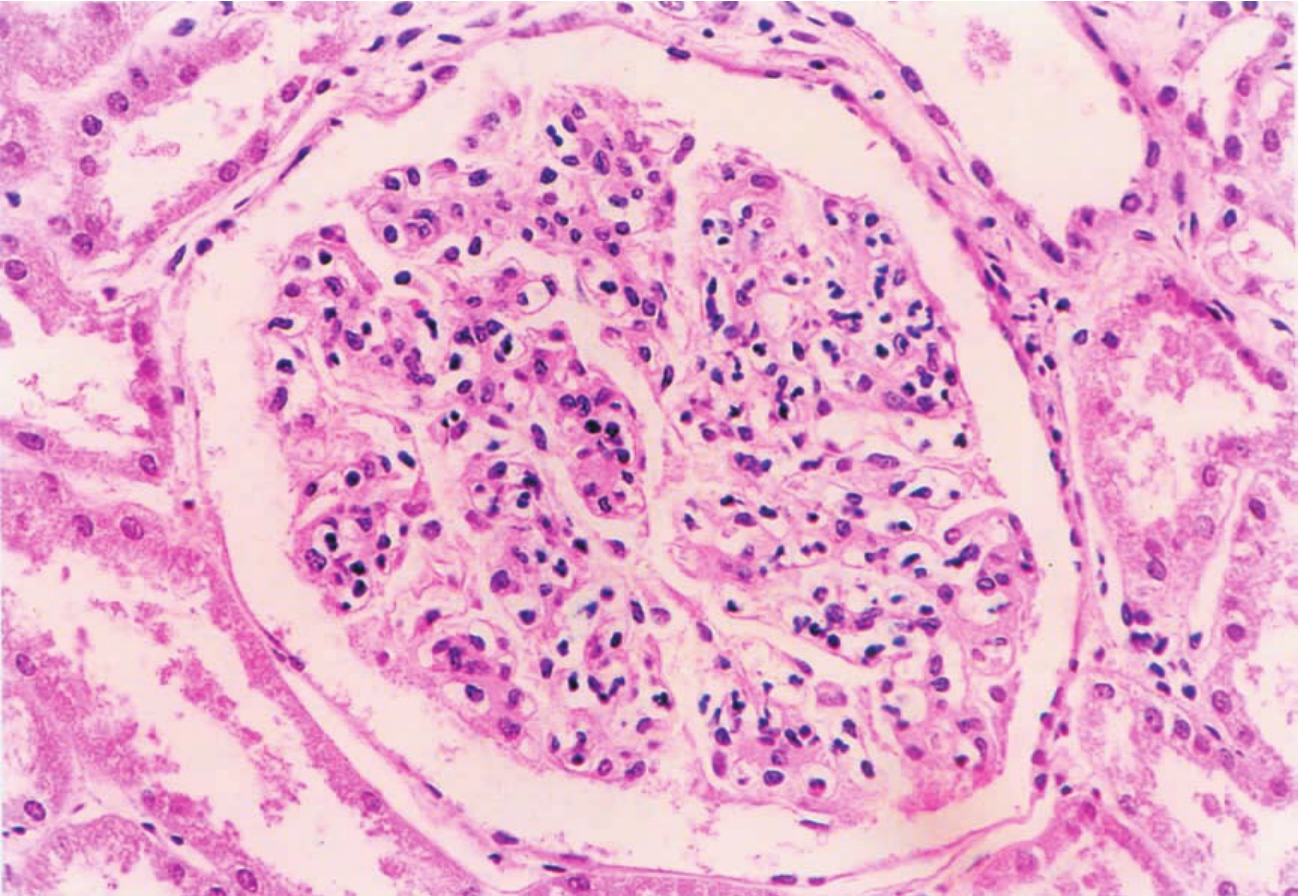
▲图1-32 肾小球细胞增多(APGN)(HE ×200)
肾小球内细胞数明显增多,包括血管襻内皮、系膜细胞增生,伴有炎症细胞浸润
内皮细胞增生主要发生于以急性炎症为表现的肾炎,如急性弥漫增生性或新月体性肾炎等,且常伴有细胞肿胀,有时受损后可有血小板黏附或血栓形成,从而导致毛细血管腔的狭窄,甚至闭塞而减少肾小球的滤过率。
系膜细胞增生是多种类型肾炎最常见的形态改变,且常伴有基质增多,有时系膜区扩大可沿内皮下间隙伸展,称为系膜插入(mesangial interposition),致使毛细血管管壁增厚、管腔狭窄。当系膜基质形成过多,并发生节段性毛细血管襻硬化时,致使肾小球毛细血管襻形成以扩大系膜区为中心的分叶状(图1-33),可常见于膜性增生性肾炎、Ⅳ型狼疮性肾炎等,系膜基质增多也是导致整个肾小球发生硬化的重要原因之一。
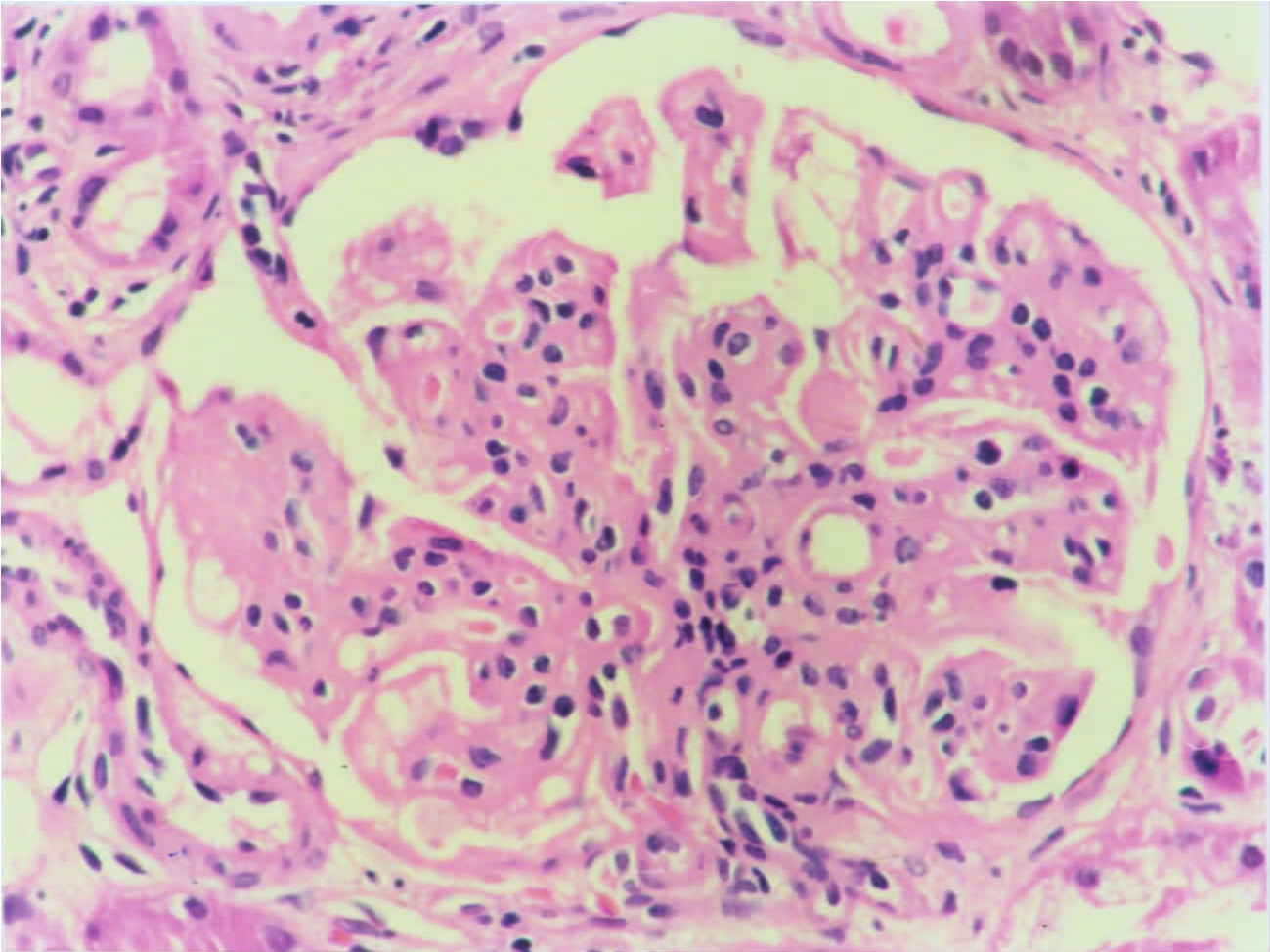
▲图1-33 肾小球血管襻分叶(MPGN)(HE ×200)
小球血管襻呈分叶状,其系膜细胞增生、基质增多伴血管壁不规则增厚
上皮细胞增生通常指在肾球囊腔内形成两层以上的细胞团块,在切面上可呈现新月形或环形,称为新月体(crescent)。其成分除上皮细胞外,尚有大量纤维蛋白、纤连蛋白和单核细胞。病变早期,增生的细胞主要是壁层上皮细胞,并伴有单核细胞,故称细胞性新月体(图1-34)。以后在单核细胞分泌的碱性成纤维细胞生长因子(bFGF)、IL-1、TNF和γ-干扰素(γ-IFN)等作用下,转化为纤维性新月体(图1-35)。新月体在球囊腔内的形成,常可压迫整个毛细血管球,甚至阻塞肾小球尿极,致使肾小球血流量的严重减少和肾球囊内压增高而影响肾小球的滤过率。因此,新月体形成被认为是肾炎的一种严重病变。肾组织中有大量新月体形成的病例,其预后往往不佳。
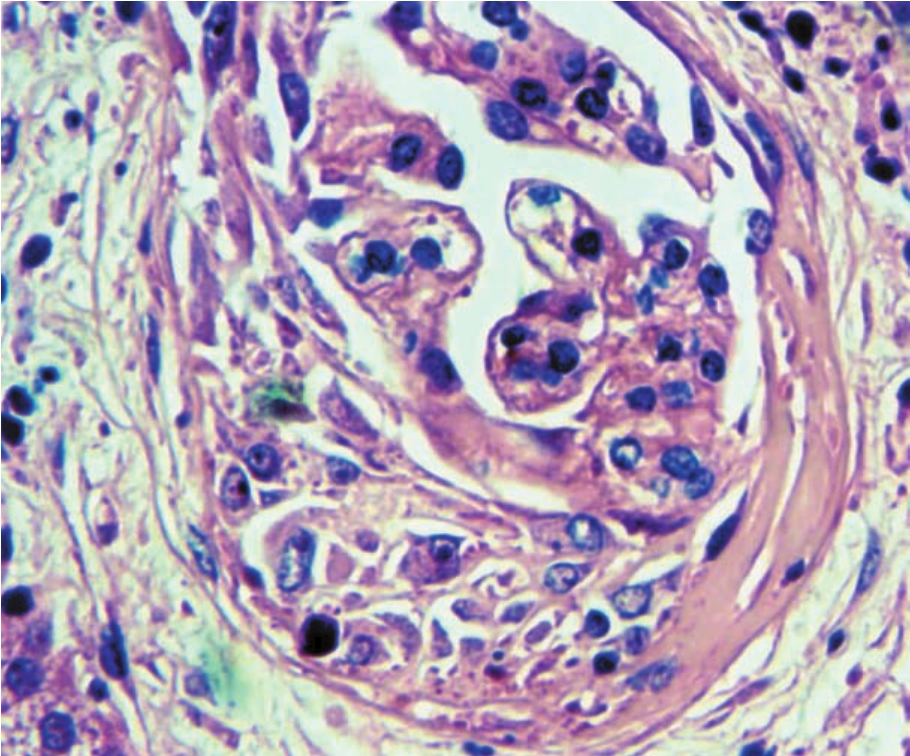
▲图1-34 细胞性新月体(HE ×800)
肾球囊腔内形成呈半月形细胞性新月体,伴少量纤维组织增生
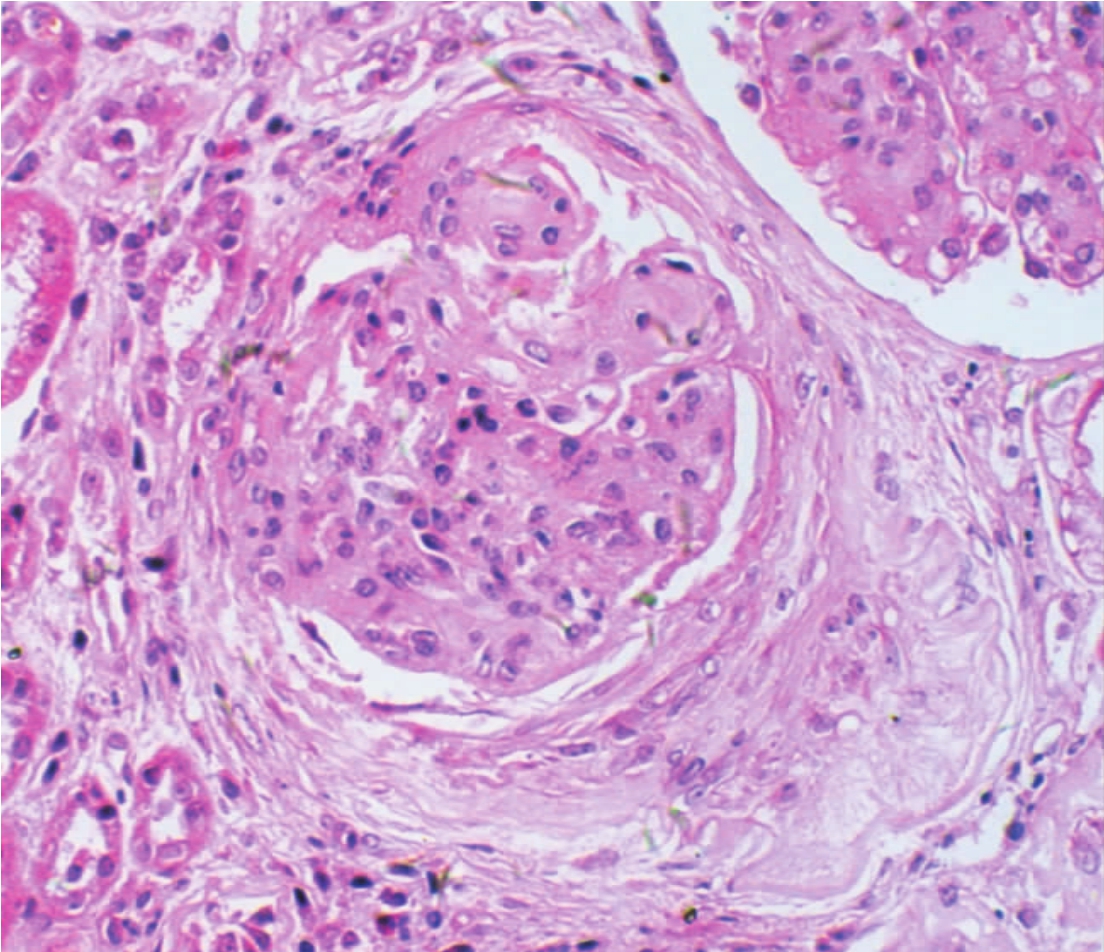
▲图1-35 纤维性新月体(HE ×200)
肾球囊腔内形成呈半月形纤维组织增生灶
(二)基膜增厚
基膜增厚(thickening of GBM)主要由以下两种因素造成:①免疫复合物沉积,尤其在上皮下或内皮下区沉积的免疫复合物周围,往往有大量新生的基膜样物形成,如膜性肾炎、膜性增生性肾炎等,其他沉积物还有纤维蛋白、淀粉样蛋白、冷球蛋白或异常呈纤维性排列的蛋白等。②系膜基质和细胞的插入,如膜性增生性肾炎、狼疮性肾炎等,也可因基膜本身增厚造成,如糖尿病肾病等。增厚或新生的基膜因其理化性状的改变,如硫酸乙酰肝素等负电荷成分的减少,致使基膜的通透性增加而引起血浆蛋白的大量漏出,这是导致大量蛋白尿(如肾病综合征)的病理基础。增厚的基膜在病理情况下不再被酶所降解,故难以恢复原状,可引起血管腔的狭窄或闭塞(图1-36),这是引起肾小球硬化伴透明变性的又一个重要原因。
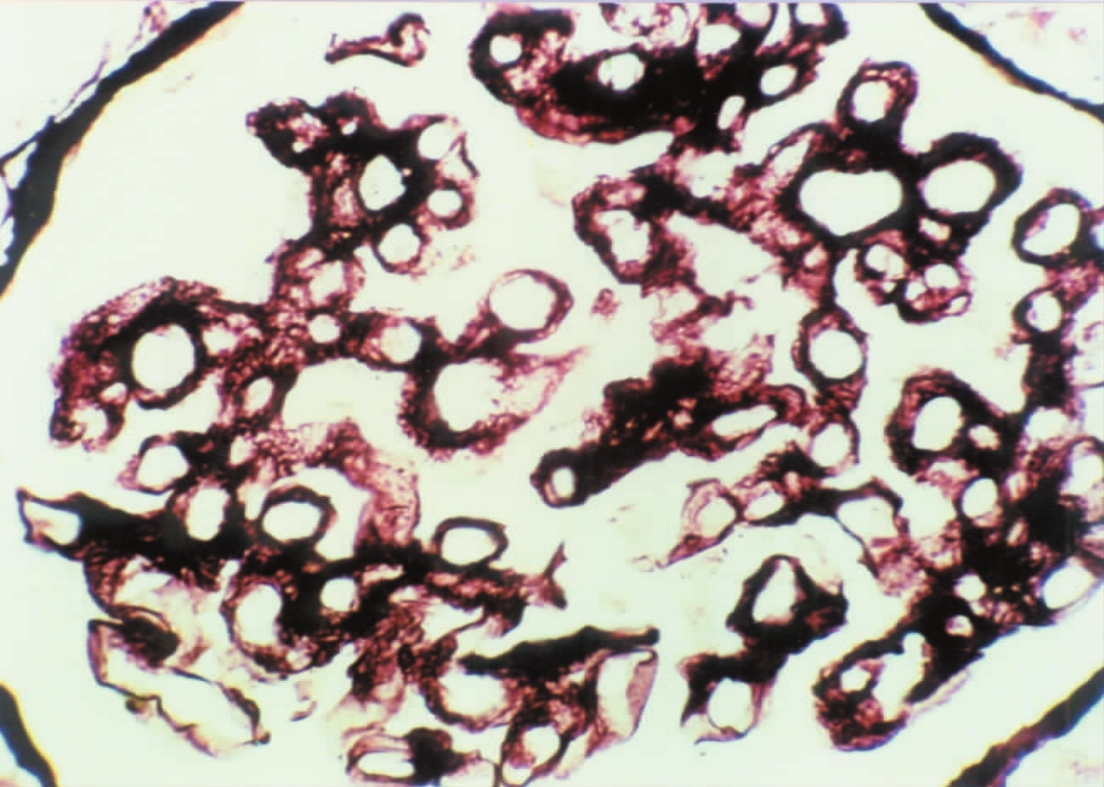
▲图1-36 肾小球基膜增厚(MGN)(PASM ×400)
肾小球血管襻基膜高度增厚,管腔明显狭窄
(三)坏死和炎性渗出
坏死和渗出过程常出现于急性炎症,可表现为血管壁纤维蛋白样坏死、血浆蛋白渗出和积聚、炎症细胞浸润、红细胞漏出和血管内纤维蛋白血栓形成等。这些渗出物一方面可聚集在肾小球的系膜区、肾球囊;另一方面可从尿液中排出,使尿内出现蛋白、红细胞等。原尿中的蛋白、红细胞等在肾小管内浓缩、凝聚,形成圆柱形团块,称为管型,其中常见者有透明(蛋白)管型(图1-37,1-38)、红细胞管型(图1-39,1-40)和颗粒管型等。
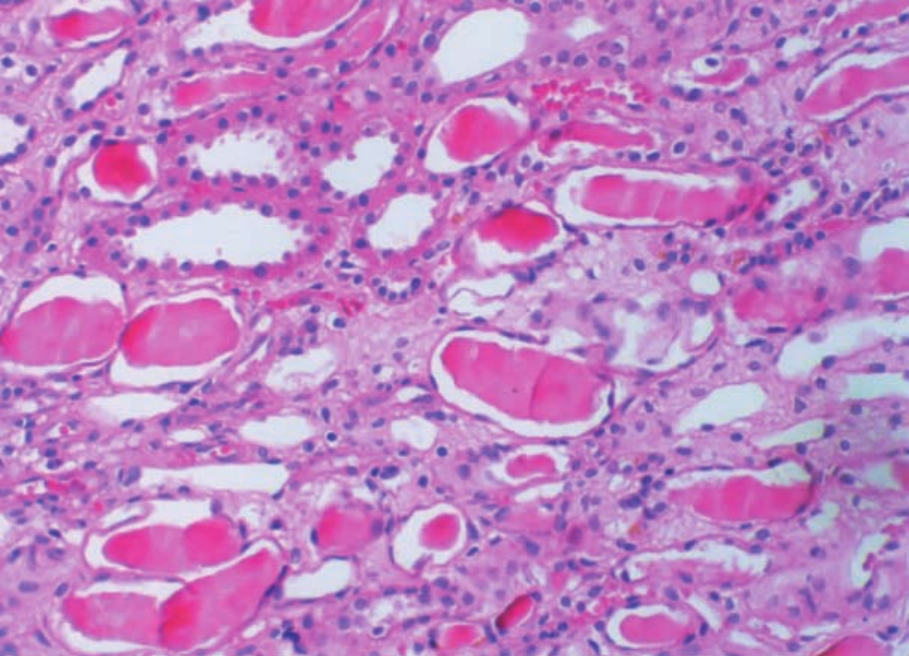
▲图1-37 透明(蛋白)管型(HE ×100)
肾髓质多个小管腔内有呈均质嗜伊红物积聚
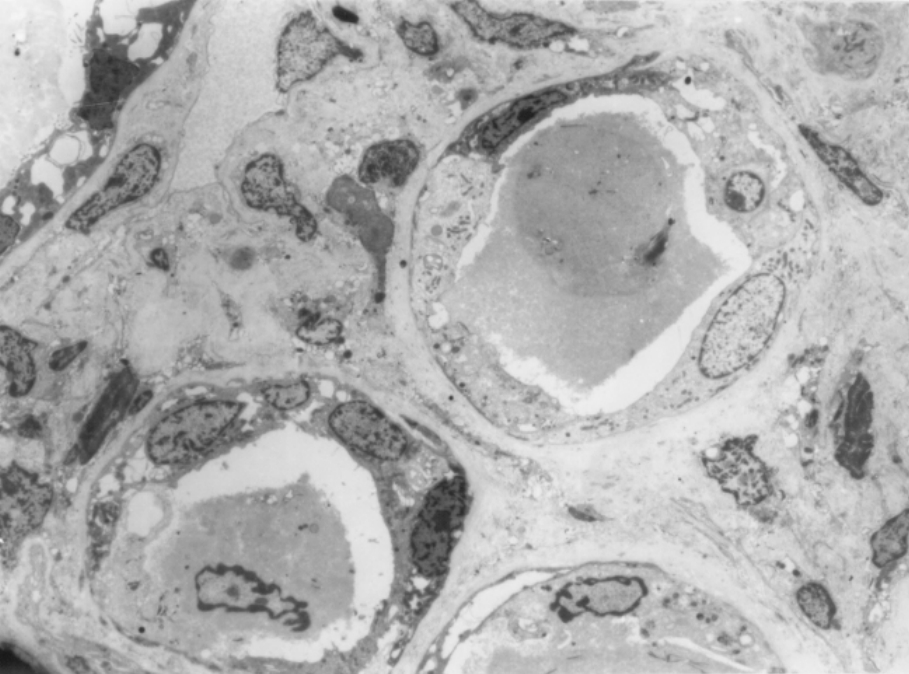
▲图1-38 透明(蛋白)管型(EM ×1 500)
肾髓质小管腔内有呈均质蛋白样物积聚
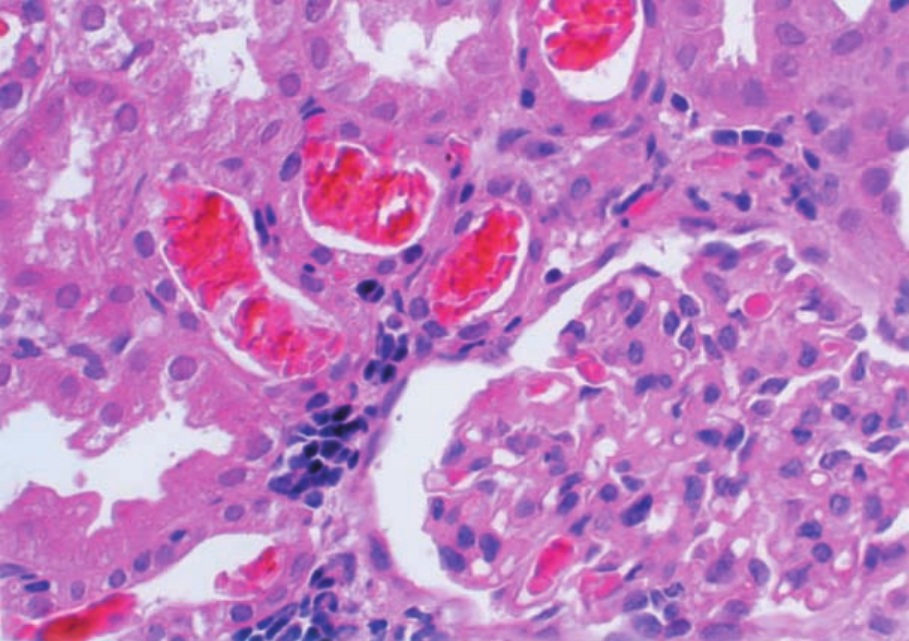
▲图1-39 红细胞管型(HE ×400)
肾皮质远端小管腔内充满红细胞
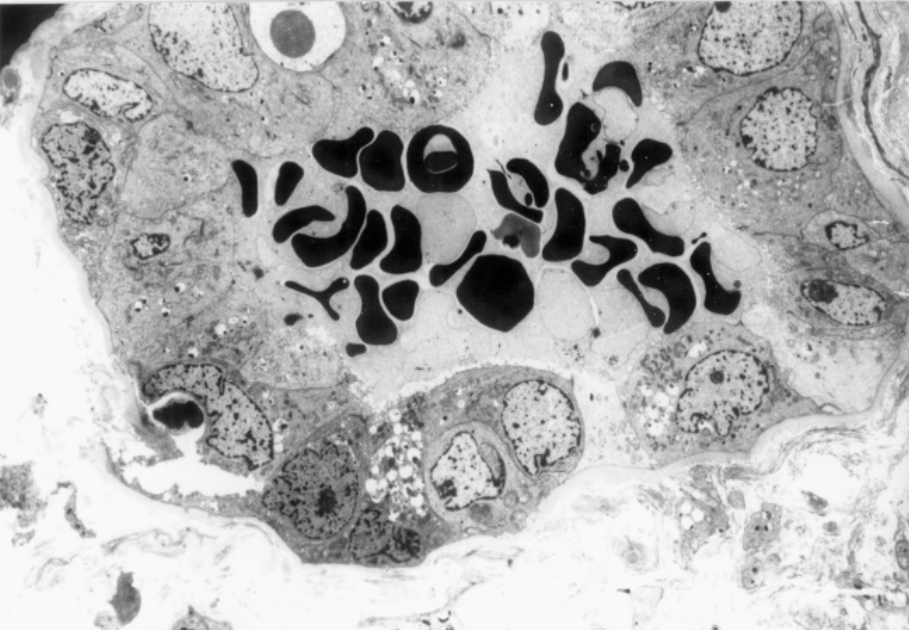
▲图1-40 红细胞管型(EM ×1 500)
肾皮质远端小管腔内充满红细胞
(四)硬化和透明变性
肾小球硬化伴透明变性(hyalinosis)通常是上述病变发展的最终结果,常来自肾小球系膜基质增多、基膜增厚、新月体纤维化以及渗出物机化等病变。其中以系膜基质增多和基膜增厚为主的病变,通常以Ⅳ型胶原沉积为主,一般称为硬化(sclerosis),而后者往往以Ⅰ、Ⅲ型胶原为主,则称为纤维化(fibrosis)。肾小球硬化伴透明变性,也可呈弥漫性或局灶性,球性或节段性,故有弥漫性球性硬化和局灶节段性硬化之分。发生硬化的肾小球毛细血管襻塌陷、管腔闭塞,进而发生透明变性而成为透明变小球(图1-41,1-42)。
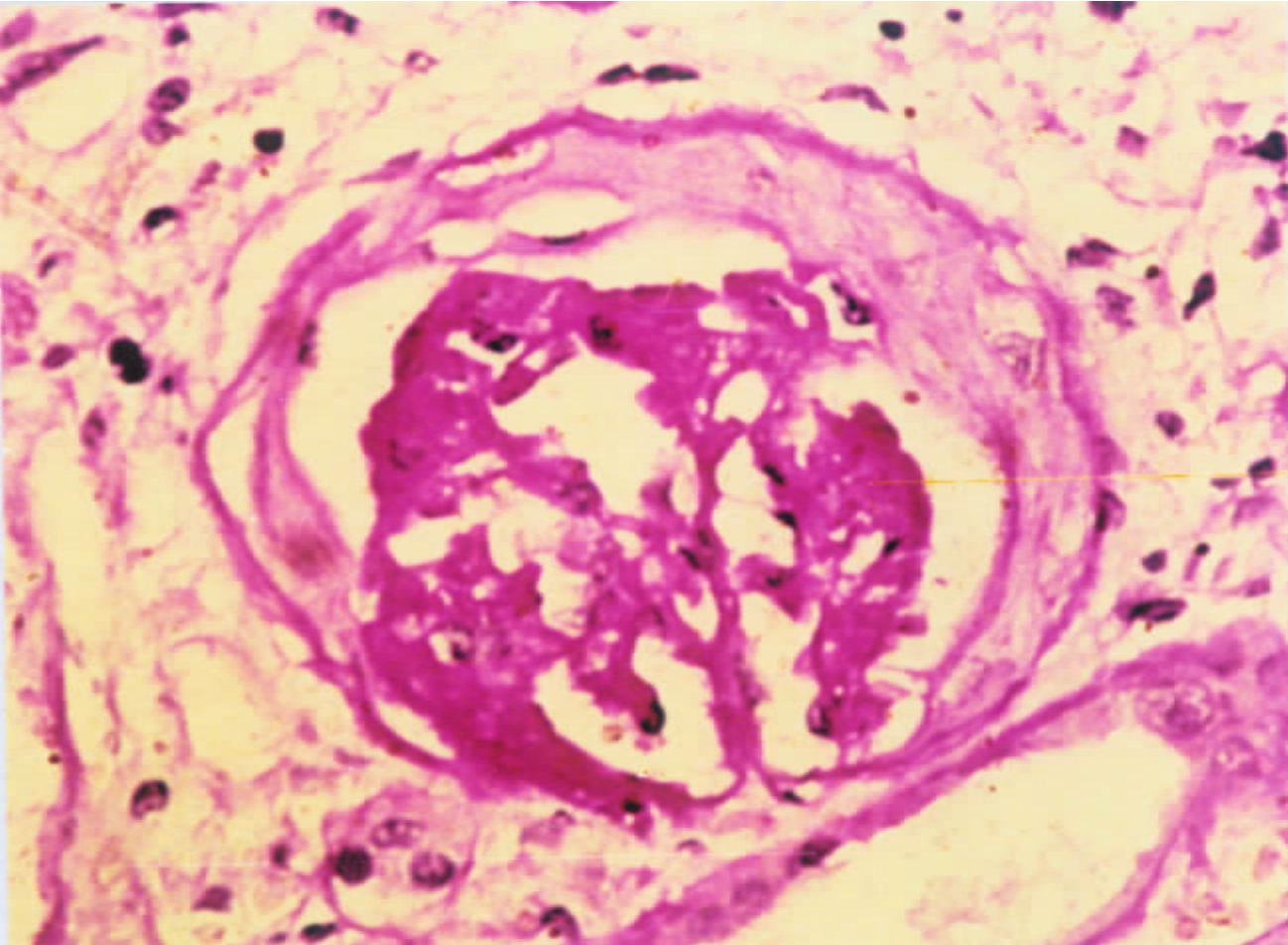
▲图1-41 硬化肾小球(PAS ×200)
硬化肾小球血管襻管腔已闭塞,其中央呈PAS染色强阳性,球囊壁增厚,呈PAS染色弱阳性
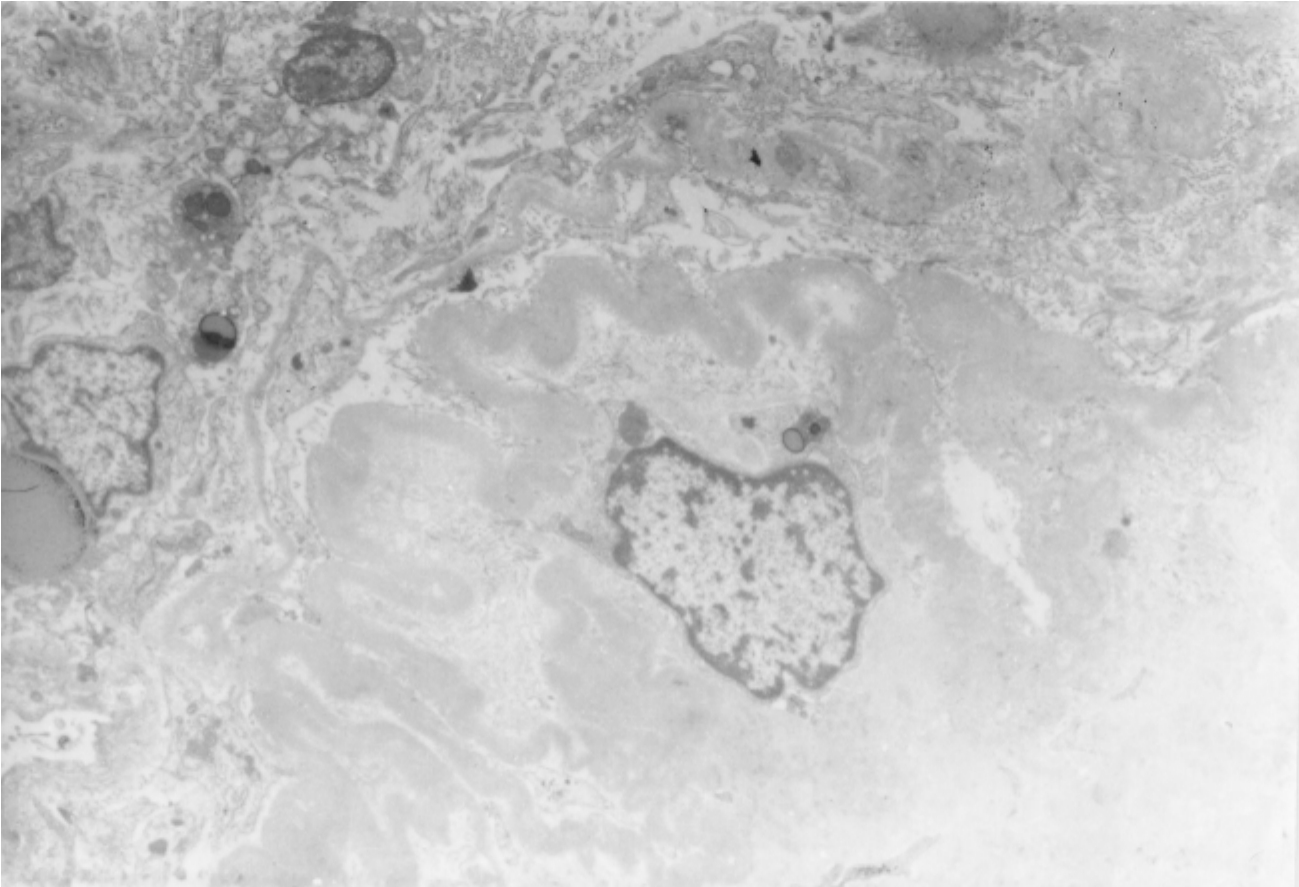
▲图1-42 硬化肾小球(EM ×4 500)
图上方呈现密集排列的胶原纤维束,图下方则为均质电子透明样物,为残存的基膜和基质
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















