第一节 肾解剖学和组织学
肾(kidney)是人体泌尿系统最重要的组成部分,也是机体重要的排泄器官之一。它以形成尿液的形式,排出体内生成的各种代谢终末产物,如尿酸、尿素和肌酐等,以防止机体中毒;通过对尿生成过程的调节,改变水、电解质和其他化学物质的排出量,以维持机体体液和电解质平衡;通过生成氨和氢离子调节人体的酸碱平衡;产生和分泌多种激素和生物活性物质,如红细胞生成素、肾素、前列腺素、激肽以及1,25-二羟胆钙化醇等,分别参与对人体造血、心血管活动和骨代谢的调节。一旦肾功能受到损害,可致机体内代谢终末产物的潴留,水、电解质和酸碱平衡的破坏,严重者可引起肾衰竭,并最终可因尿毒症而危及患者的生命。
一、肾解剖学
肾是人体内为数不多的成对器官。人的正常肾分别位于腹后壁第12胸椎和第3腰椎之间的脊柱两旁,左、右侧各有一个。肾外观状如大豆,成人的肾大小约为11cm×6cm×2.5cm,男性肾重125~170 g,女性肾重115~155 g。肾表面被脂肪组织和肾筋膜(又称纤维膜)组成的脂肪囊包裹。在外观上,肾可分为前、后面,上、下端和内、外缘,肾内缘中部形成凹陷,呈腔隙状,称为肾窦(renal sinus),内有肾血管、淋巴管、神经及肾盏和肾盂的出入,故被称为肾门(renal hilus)。除上述结构外,肾窦内还含有数量不等的脂肪组织和疏松结缔组织。
肾的额状切面显示肾实质被分为两部分(图1-1),即边缘部的肾皮质(renal cortex)和中心部的肾髓质(renal medulla)。肾皮质(除肾柱外)厚约1cm,呈暗红色,由髓放线(medullary ray)及皮质迷路(cortical labyrinth)组成,前者是因髓质而来的直行管道呈辐射状伸入皮质形成,故呈条纹状;而后者即为髓放线间的肾皮质,常呈颗粒状。肾髓质则由约14个呈扇形的肾锥体(renal pyramid)构成,内有许多直行管道,故呈淡红条纹状。肾锥体又可分为外髓(outer medulla)和内髓(inner medulla)两部分,外髓较宽大,与肾皮质相连,条纹致密,色较深;内髓条纹较稀疏,色较浅,其顶部呈钝圆,称为肾乳头(renal papilla)。每个肾乳头顶端有10~20个小孔,是集合管的开口处,又称乳头孔。由肾单位生成的尿液就是经过此孔排入肾小盏和肾盂的。肾锥体间肾皮质称为肾柱(renal column或column of Bertin)。
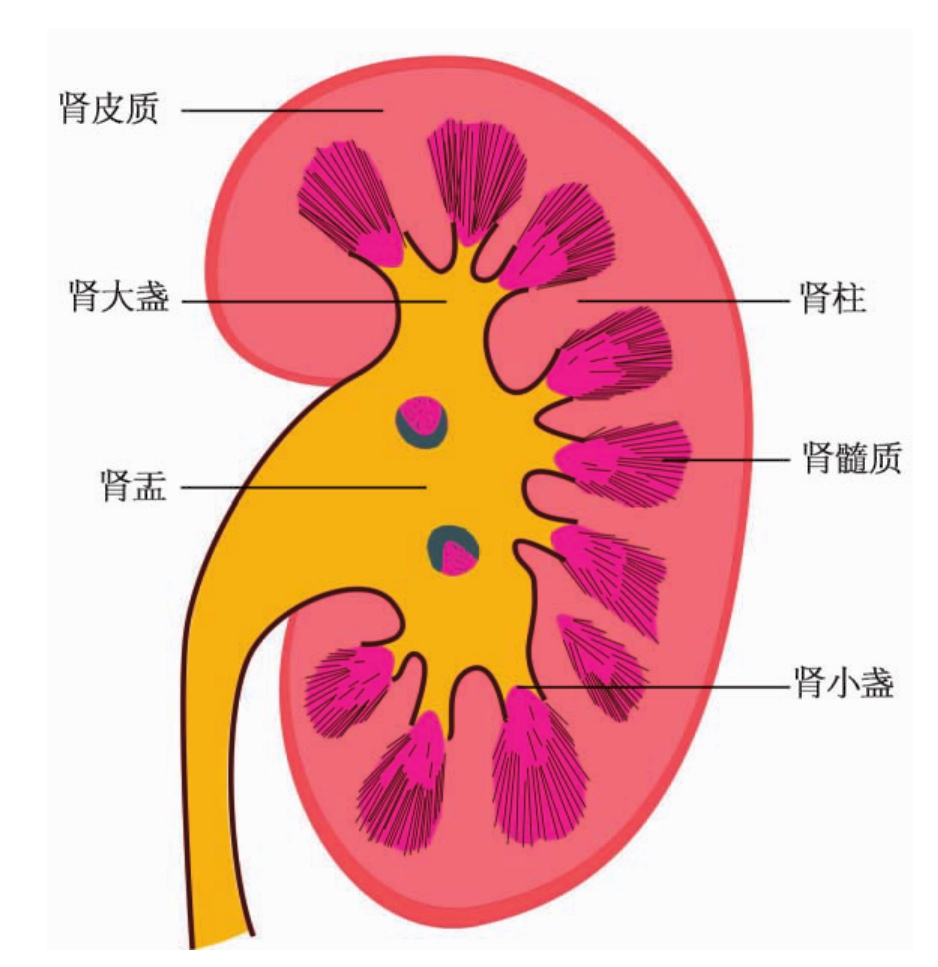
▲图1-1 肾额状切面结构模式图
二、肾组织学
(一)肾单位
肾的基本结构和功能单位是肾单位(nephron or nephron unit)。人每侧肾有100万~150万个肾单位。肾单位由其膨大如球的起始部,即肾小球(glomerulus)(严格地应称其为肾小体,即renal corpusle)及其相连的圆柱状上皮性管道的泌尿小管(uriferous tubule)组成。根据肾小球所在皮质部位的不同,可将肾单位分为浅表肾单位、中层肾单位和髓质旁肾单位3类。浅表肾单位(superficial nephron)的肾小球位于肾皮质的浅层,数量较多,体积略小,其泌尿小管中的髓襻较短,只伸达外髓,有时可不进入肾髓质。髓质旁肾单位(juxtamedullary nephron)的肾小球则靠近肾锥体,数量较少,体积较大,其髓襻较长,可伸达内髓,甚至到达肾乳头。而中层肾单位(midcortical nephron)的肾小球位于肾皮质中层,其数量、体积及髓襻长度则介于上述两类肾单位之间。
肾单位是生成尿液的基本单位,其中肾小球是由其肾毛细血管襻组成。肾毛细血管襻的功能是滤过血浆。将毛细血管球包围而呈球状的扁平上皮囊,即肾球囊或鲍曼囊(Bowman capsule)只接受滤液(又称原尿)。组成肾单位的泌尿小管的末端部分,即集合管(严格地说不属于肾单位)则可浓缩尿液,并作为排泄器将尿液排入肾小盏。泌尿小管各段在肾实质内的分布和走向具有一定的规律性(图1-2)。与肾小球相接的肾小管是指近端小管(proximal tubule)、中间小管(intermediate tubule)或髓襻细段(thin limb of Henle loop)和远端小管(distal tubule)。近端小管又可分为曲部(convoluted part),即近曲小管;直部(straight part),即近直小管,其曲部与肾球囊相连,并盘曲行走于肾小球周围,而直部位于髓放线,沿其直行至外髓处成细段,后者又包括降支和升支,随细段升支上行后其管径骤然增粗,演变成远端小管。后者也可分为行走于肾皮质髓放线的直部(远直小管)和盘曲行走于肾小球周围的曲部(远曲小管)。由近端小管直部、中间小管(细段)和远端小管直部三者构成的呈“U”形的髓襻(medullary loop),又称亨勒襻(Henle loop)。远端小管的末端连接集合管系(collecting duct system),后者分别由起始段集合小管(initial collecting tubule)、集合小管(collecting tubule)和集合管(collecting duct)组成,集合管则开口于肾乳头。
鉴于泌尿小管各段在肾组织内有特定的行走路线,因此在肾组织切片中,肾肉眼切面所示的各部分均有其相应的组织结构,如皮质迷路主要由肾小球、近端小管曲部、远端小管曲部和连接小管组成髓放线和外髓外段内主要有近端小管直部、远端小管直部和皮质集合管;外髓内段中主要有髓襻细段降支、远端小管直部和外髓集合管;内髓中主要有髓襻细段降支和升支及内髓集合管。
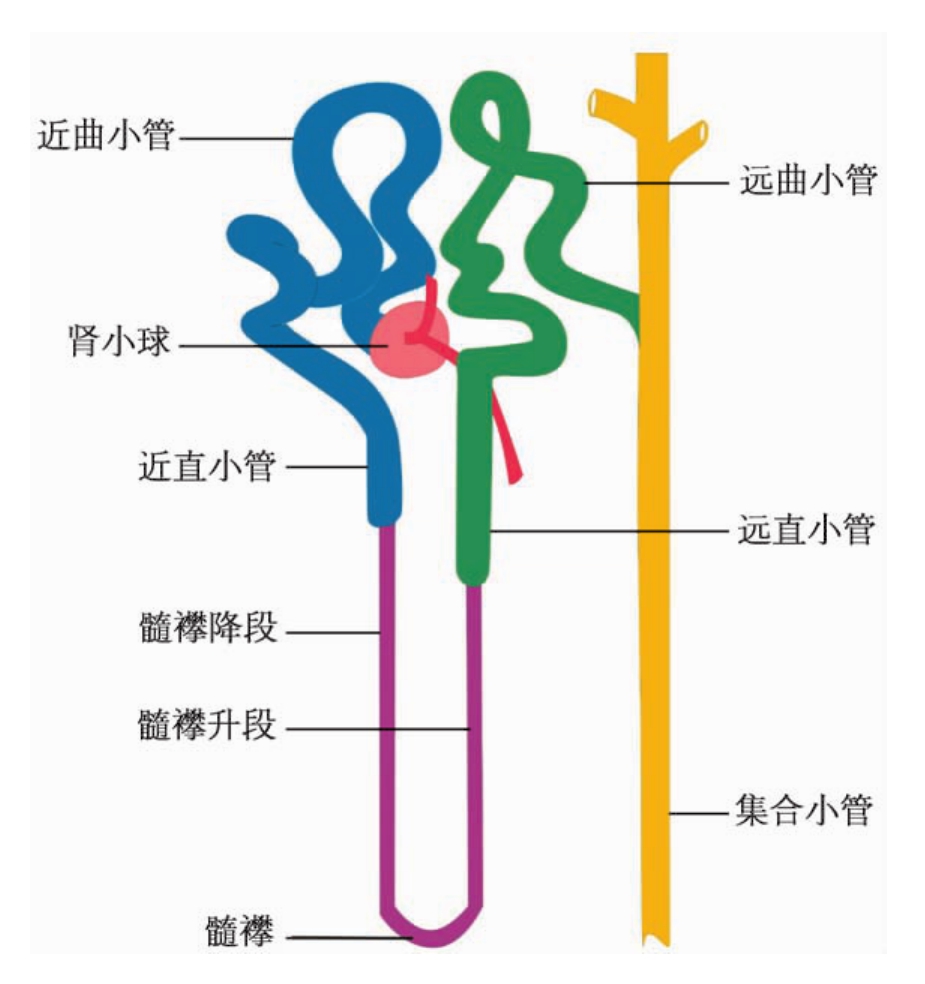
▲图1-2 泌尿小管各段在肾实质内分布模式图
(二)肾小球
肾小球(glomerulus)是一个呈球状、由血管-上皮性结构组成的器官,包括呈小叶状排列的毛细血管球和呈杯形球状、内衬扁平上皮的肾球囊两部分。
1.毛细血管球毛细血管球组成肾小球的中心部分,其血管来自肾动脉的终末支,即入球微动脉(细动脉)(图1-3,1-4),后者进入肾小球后常分成4~8支,故血管球通常分为4~8个小叶,它们互相吻合成球状的毛细血管襻,共有20~40个(图1-5,1-6),最终它们又汇聚成出球微动脉而离开肾小球,并成为肾小管的营养血管。由入、出球微动脉(细动脉)构成的肾小球出入处,常被称为肾小球的血管极(图1-7)。肾小球毛细血管襻又可分为周边部和轴心部两部分。
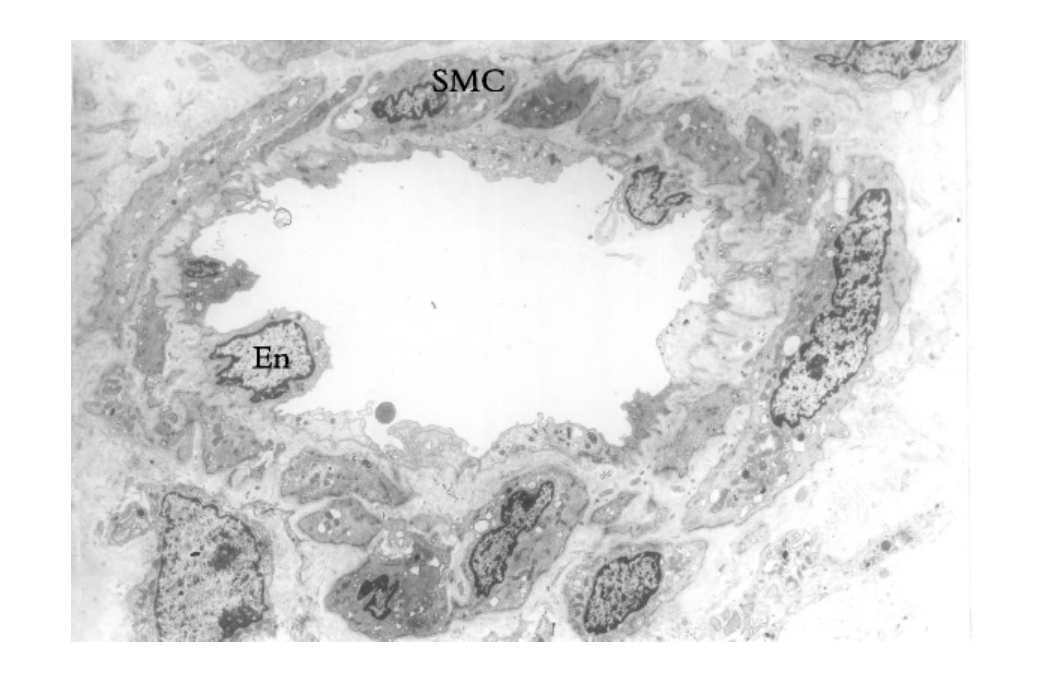
▲图1-3 肾微动脉(EM ×2 250)
图示管壁由内皮细胞(En)、平滑肌细胞(SMC)和基膜及血管周细胞组成
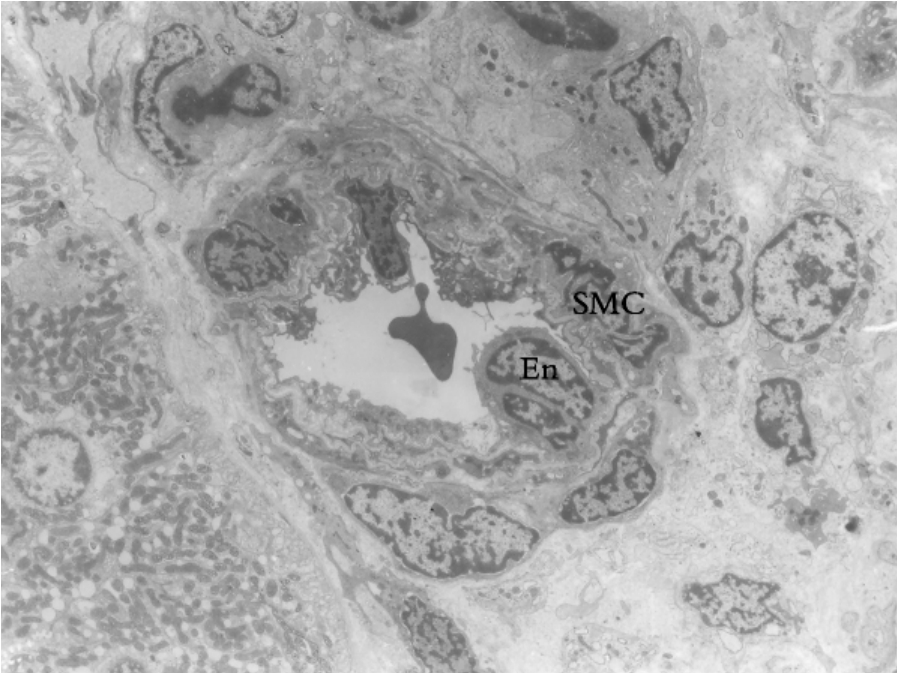
▲图1-4 肾微动脉(EM ×2 250)
图示微动脉腔内红细胞和管壁的内皮细胞(En)、平滑肌细胞(SMC)、基膜及血管周细胞
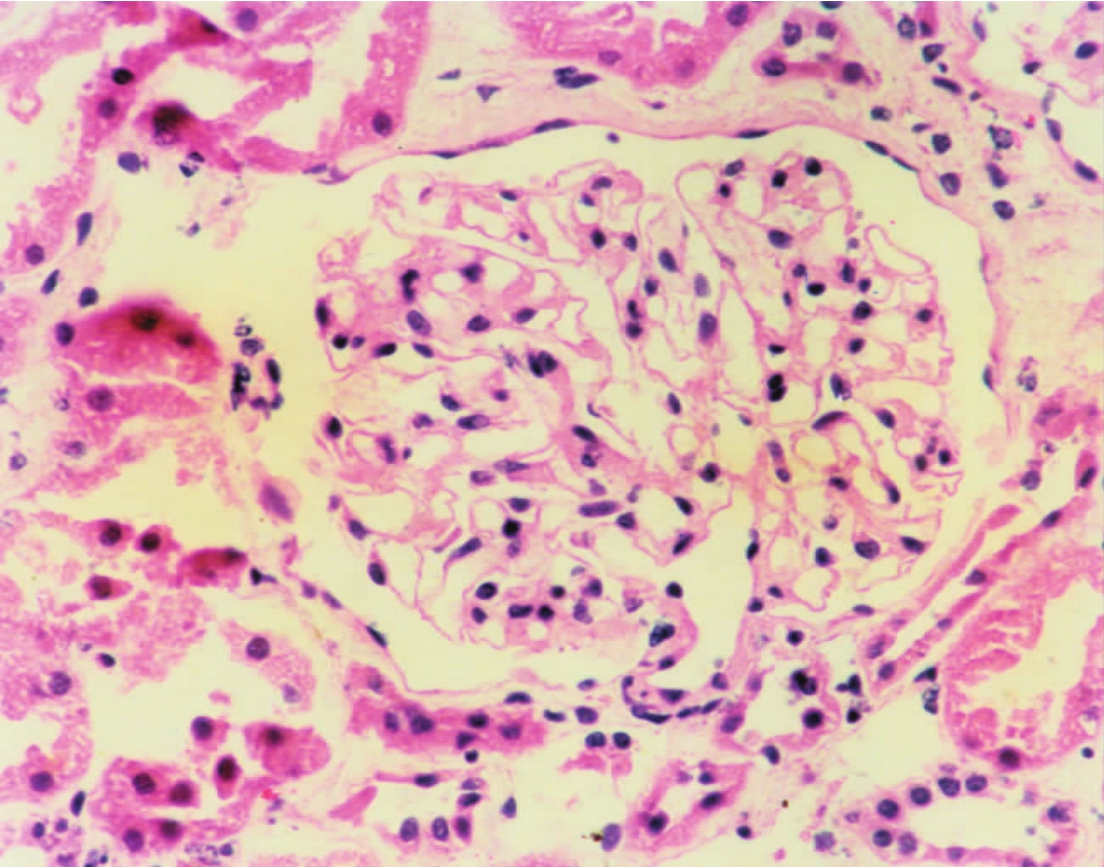
▲图1-5 正常肾小球(HE ×200)
肾小球由中央的毛细血管襻及周边的肾球囊腔组成,其血管腔开放,管壁菲薄,细胞散在分布
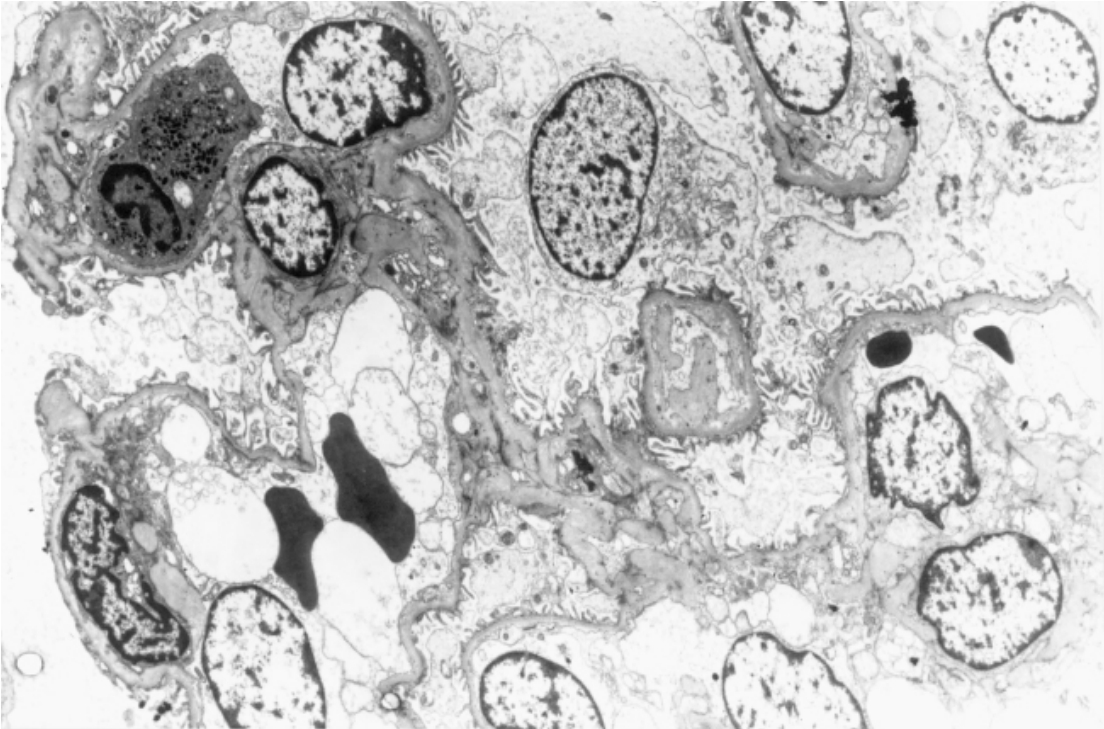
▲图1-6 肾小球毛细血管襻(EM ×2 100)
图示若干血管襻超微结构,包括基膜、内皮细胞、系膜细胞、上皮细胞和管腔内红细胞、中性粒细胞
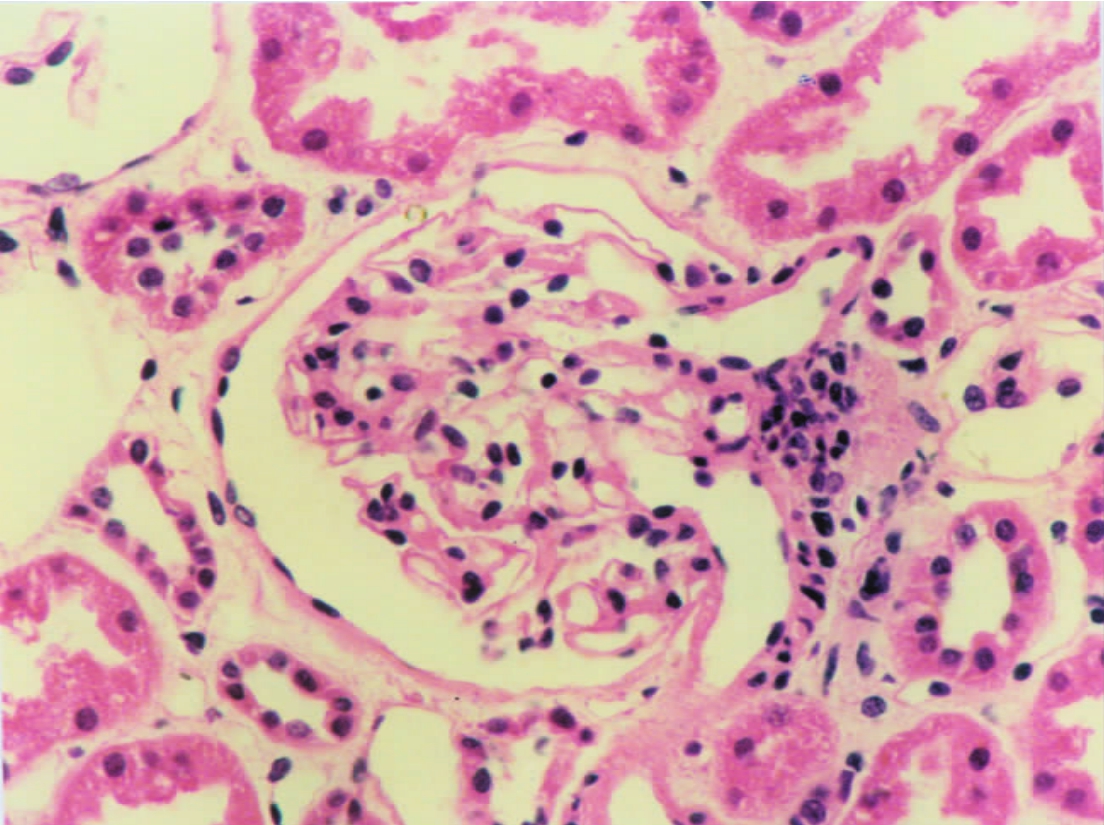
▲图1-7 肾小球血管极(HE ×200)
肾小球入、出球微动脉和球门处聚集的若干球外系膜细胞
1)周边部即为肾小球的滤过膜,在电镜下可清晰地显示由毛细血管内皮细胞、基膜和肾球囊脏层上皮细胞三者组成(图1-8)。在此3层滤过膜中,内皮细胞与基膜间的间隙,在电镜下常称为内皮下区(subendothelial region),而上皮细胞与基膜间的间隙则称为上皮下区(subepithelial region)。
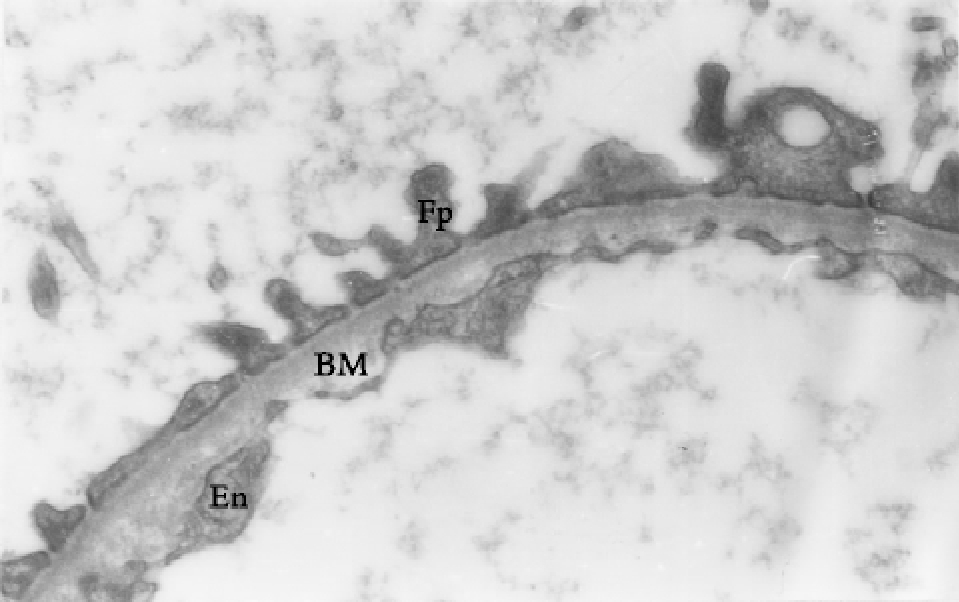
▲图1-8 肾小球滤过膜结构(EM ×12 000)
滤过膜呈现3层结构,自上至下分别是上皮细胞足突(Fp)、基膜(BM)和内皮细胞(En)胞质
(1)内皮细胞(endothelial cell)由其构成滤过膜的内层,通常在一个终末端的毛细血管腔内仅内衬1~2个内皮细胞,偶见3个(图1-9)。在电镜下发现其细胞体通常位于毛细血管襻的轴心部(图1-10),而位于周边部的内皮细胞胞质则呈扁平状、较薄,且不连续,形成许多直径为50~100 nm的呈圆形或卵圆形的窗孔(图1-8,1-11)。与其他部位(出球微动脉流出段除外)的内皮细胞不同之处在于其内皮细胞胞质的窗孔间缺少隔膜性结构,呈开放式,故血浆内的任何大分子物质均可在此通过,并可进入系膜区。内皮细胞表面因富于多价阴离子蛋白聚糖,如足细胞糖萼(podocalyxin)等而使其带负电荷。近年研究表明,内皮细胞可合成和释放内皮血管肽-1和内皮细胞松弛因子等,而且在上述微动脉输出段,其内皮细胞排列紧密,并向血管腔凸出,这一特征性排列被认为是特异性切力应激性受体,可参与对凝血、炎症和免疫反应的调控。
(2)基膜(basement membrane,BM)构成滤过膜的中间层,厚240~340 nm。在电镜下,基膜可被分为内、外疏松层和致密层(图1-11)。其主要成分是Ⅳ型胶原、黏合性糖蛋白(包括纤连蛋白、层连蛋白等)和呈多聚阴离子的硫酸乙酰肝素蛋白聚糖,也可含有Ⅴ、Ⅵ型胶原,淀粉样P成分,巢蛋白(entactin/nidogen)等。基膜依赖其机械作用(Ⅳ型胶原组成的三维结构网)及电荷屏障(多聚阴离子的硫酸乙酰肝素蛋白聚糖)作用,可有效地阻拦血浆内带电荷的白蛋白等小分子物质的漏出,故它是滤过膜中极其重要的一道屏障。基膜富于糖蛋白类物质(主要是纤连蛋白、层连蛋白和巢蛋白),故可用过碘酸-雪夫(periodic acid-Shiff,PAS)和过碘酸六胺银(periodic acid silver methenamine,PASM)等方法分别将其染成红色和黑色(图1-12,1-13),此特征十分有助于观察肾小球基膜的改变,从而为对肾小球疾病作出正确的组织病理学分类提供形态学依据。
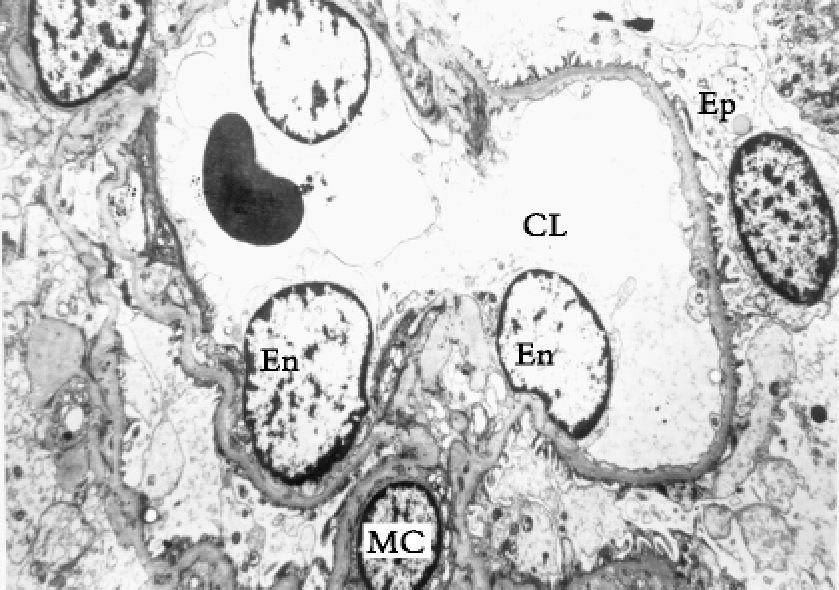
▲图1-9 肾小球血管襻(EM ×6 750)
图示一完整的血管襻,管腔(CL)内红细胞和管壁的上皮细胞(Ep)、内皮细胞(En)和系膜细胞(MC)
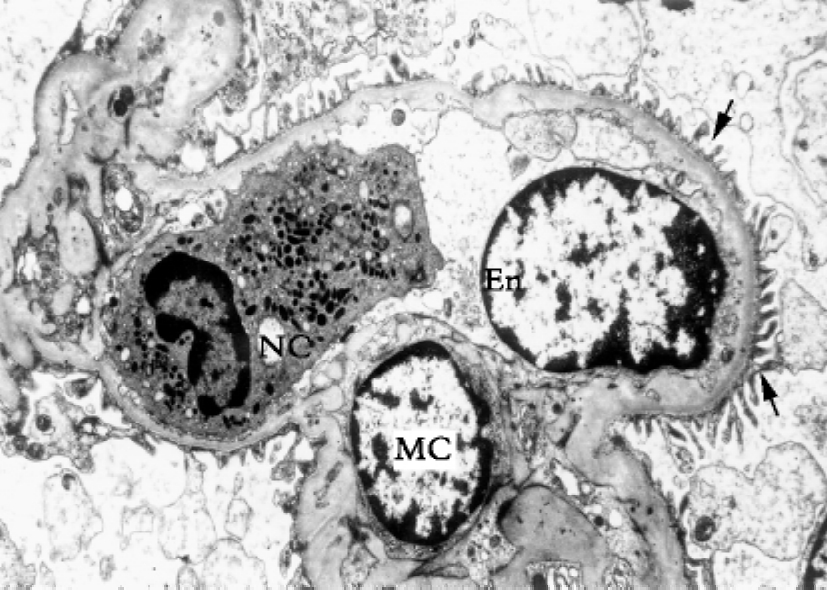
▲图1-10 肾小球血管襻(EM ×12 500)
图示管腔内中性粒细胞(NC)和滤过膜的足突(↑)、基膜、内皮细胞(En)和系膜细胞(MC)
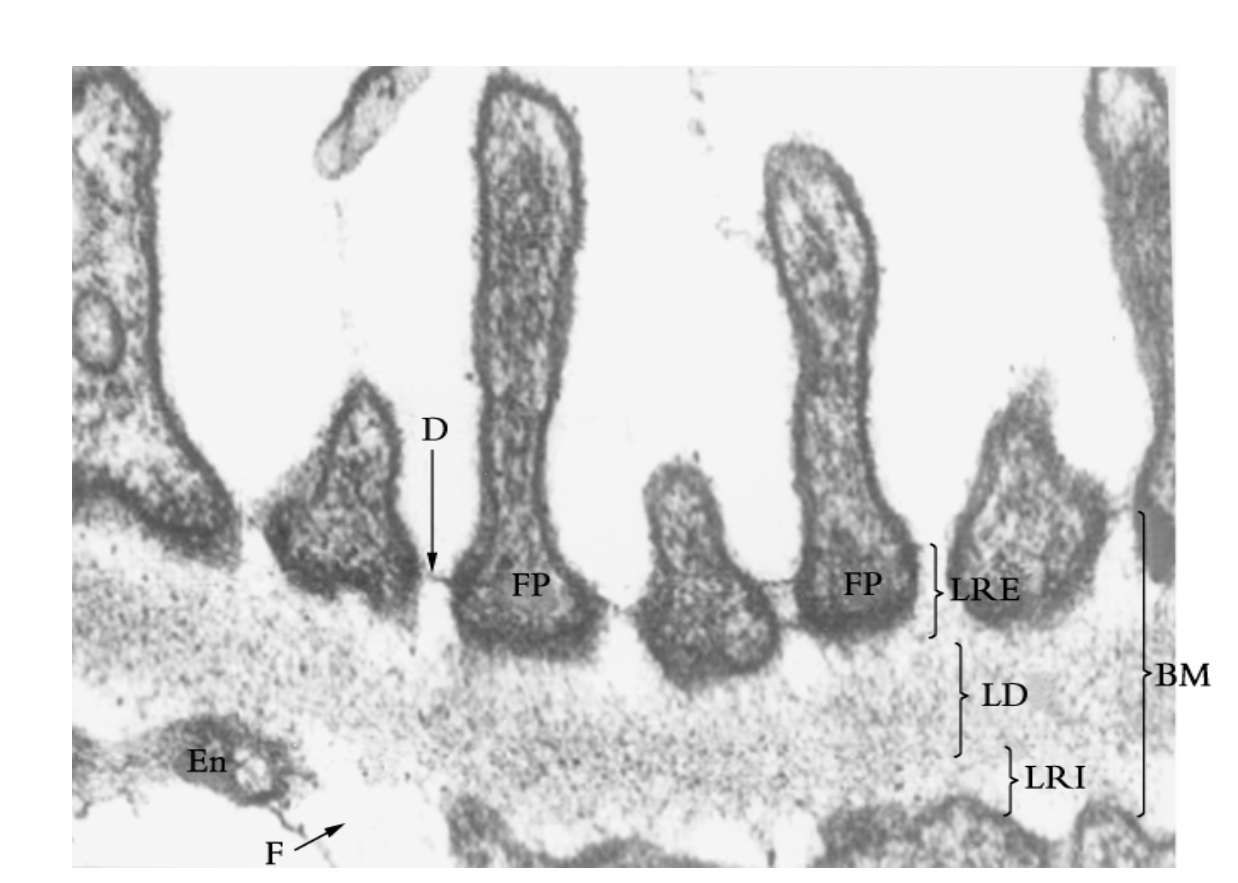
▲图1-11 肾小球滤过膜结构(EM×51 000)
滤过膜由足突(FP)、基膜(BM)和内皮细胞(En)组成,D为足突间裂孔膜,F为窗孔,LRE、LD和LRI分别代表基膜的外疏松层、致密层和内疏松层
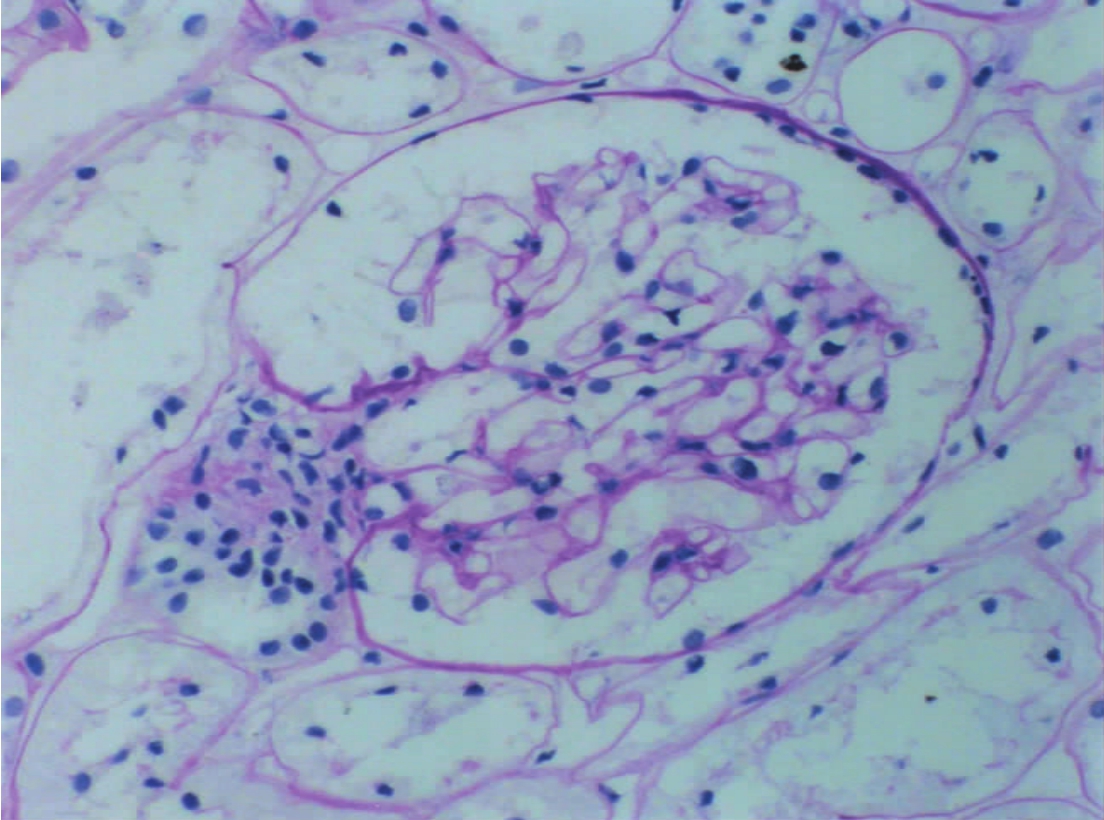
▲图1-12 正常肾小球(PAS ×200)
肾小球血管襻基膜、系膜基质和球囊壁基膜均呈红色
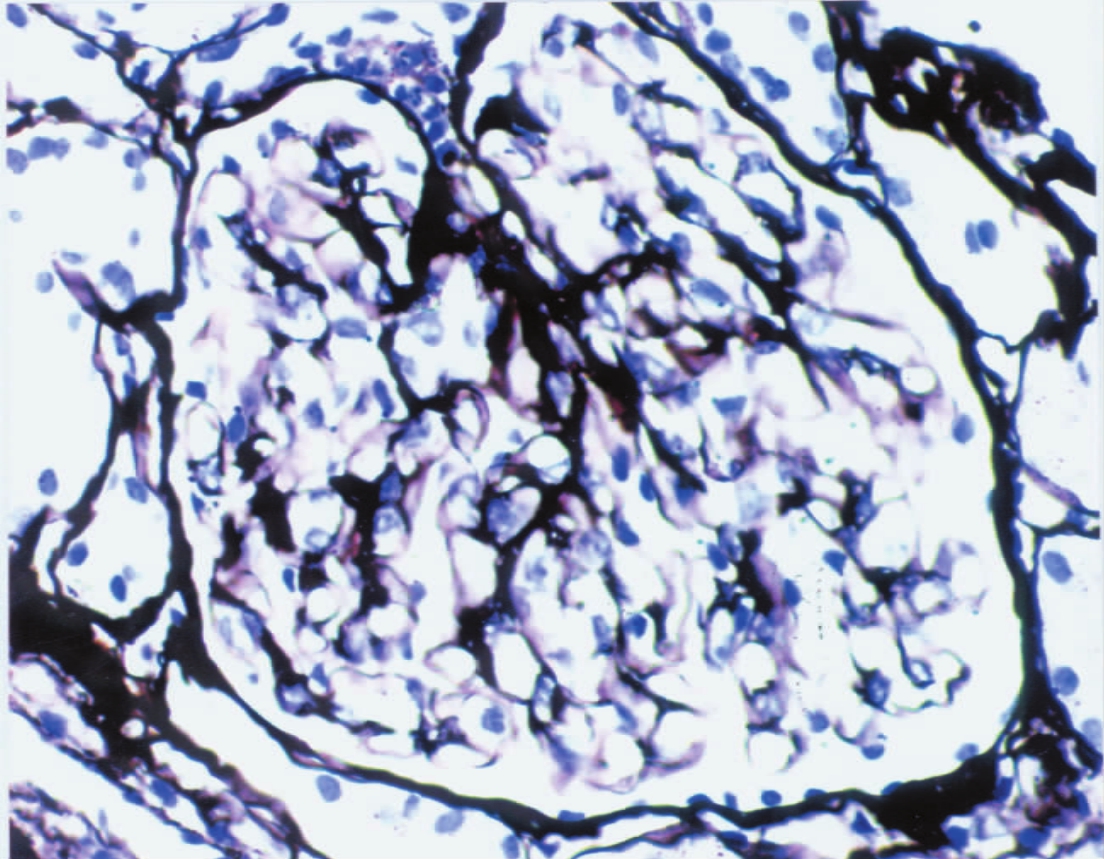
▲图1-13 正常肾小球(PASM ×400)
肾小球血管襻基膜、系膜基质和球囊壁基膜均呈黑色
近年研究证实,至少存在6种不同种类的Ⅳ型胶原基因,分别编码自α1至α6Ⅳ型胶原多肽链,分别用α1(Ⅳ)~α6(Ⅳ)表示,其中α3(Ⅳ)、α4(Ⅳ)和α5(Ⅳ)链分布于基膜的致密层,而α1(Ⅳ)和α2(Ⅳ)则位于基膜的内疏松层和系膜区,这一发现提示由α3、α4及α5链组成的网则不同于由α1和α2链组成的结构。最近研究表明,其不同链结构与功能的改变可能与某些肾小球病的发生有关,如肺出血肾炎综合征(Goodpasture syndrome)的发病则与患者生成和α3(Ⅳ)链相关的致病性抗体有关,而遗传性肾炎(Alport syndrome)则是与α5(Ⅳ)链编码基因的突变有关。
(3)脏层上皮细胞(visceral epithelial cell)构成滤过膜的外层,呈现高度分化的足细胞(podocyte),以其胞质形成许多初级、次级和三级足突(foot process)而位于基膜外侧,足突间存在直径为20~30 nm的裂孔(slit pore)(图1-11),其间架着一层由podocalyxin、podoendin和nephrin组成、如筛孔状的薄膜,每一个筛孔的直径为4~10 nm,与白蛋白分子大小接近。足突表面也因富于涎酸糖蛋白而带负电荷,这一特性不仅可阻拦白蛋白漏出,也有助于正常足突间裂孔的保持。存在于足细胞的其他膜蛋白,还有C3受体和gp330(megalin)等,后者是大鼠Haymenn肾炎的主要足突抗原,且与足细胞内质网、高尔基复合体有关。脏层上皮细胞有突出的核、发达的高尔基复合体和丰富的内质网、溶酶体和线粒体。与细胞体相反,细胞突起仅含少量细胞器,细胞体内大量的细胞器显示其有活跃的合成和分解代谢能力,也可合成基膜的某些成分。此外,在胞体或初级突起内,还含有丰富的肌微丝(图1-14)。在成人中,因某些因子,如碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)和成纤维细胞生长因子-2(FGF-2)的刺激,正常上皮细胞可能因其不能完全分裂而被其双核或多核细胞所代替。
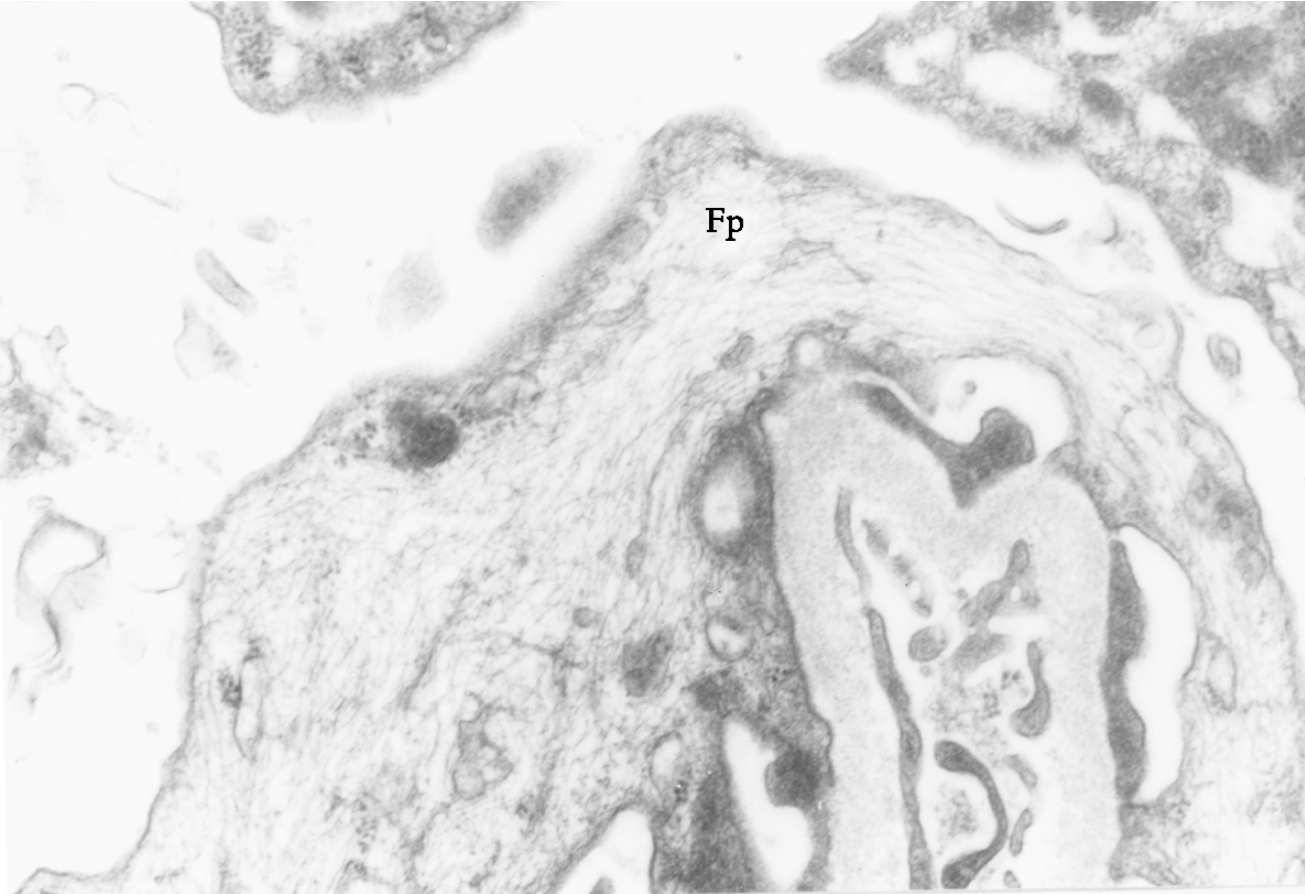
▲图1-14 足细胞肌微丝(EM ×18 000)
足突(Fp)胞质内含略呈平行排列的微丝结构
2)轴心部即系膜区(mesangium)是由球旁系膜延伸而来,构成毛细血管襻的支架组织,由呈星状的系膜细胞(mesangial cell)和呈均质的系膜基质(mesangial matrix)组成。在电镜下显示,每个终末端的系膜区只含1~2个,偶然为3个系膜细胞和少量基质。系膜细胞的形态不规则,多突起(图1-15),内含大量排列致密的肌微丝、肌动蛋白、肌球蛋白和α-辅肌动蛋白(α - actinin),可直接附着或经微纤维锚定于毛细血管襻基膜,尤多见于靠近轴心部的内皮下或系膜角处。球内系膜细胞通过裂隙或桥粒结构与球外系膜细胞和球旁器内分泌肾素的颗粒细胞发生连接。目前已证实,系膜细胞可通过合成各种缩血管因子,如前列腺烷酸、血小板活化因子而对血管收缩激素,即血管紧张素Ⅱ和心房利钠肽起反应,而且在许多免疫或非免疫反应性疾病中,不仅对许多细胞因子,如白细胞介素-1(IL-1)、血小板源性生长因子(PDGF)、白细胞介素-6(IL-6)、转化生长因子-β(TGF-β)等、炎症介质起反应,而且也可通过自分泌方式在肾小球损伤、修复过程中起重要作用,包括通过内吞巨分子胶样物、蛋白聚集物、免疫复合物等对其进行清除;经对合成或降解细胞外基质(如胶原、黏合性糖蛋白、蛋白聚糖)等影响,而最终导致其在肾小球内的积聚。除此之外,在肾小球内也有少于2%的系膜细胞属于巨噬细胞来源,其细胞表面含有Ia抗原和Fc受体,具有吞噬能力及抗原呈递功能而参与免疫反应。系膜基质的主要组成包括胶原(Ⅲ、Ⅳ、Ⅴ、Ⅵ型)和若干微纤维(fibrillin、MAGP、MP78、MP340),也含有黏合性糖蛋白,如纤连蛋白和多种小分子蛋白聚糖,即双链蛋白聚糖(biglyan)、饰胶蛋白聚糖(decorin)等。其最基本的超微结构组成是微纤维网,与基膜胶原微纤维网一样也呈三维结构,但含有较多致密的弹力纤维,后者为非管状结构,不分支,直径约为15 nm,并可锚定于系膜细胞和毛细血管基膜上,从而在肾小球的血流动力学中发挥重要作用。
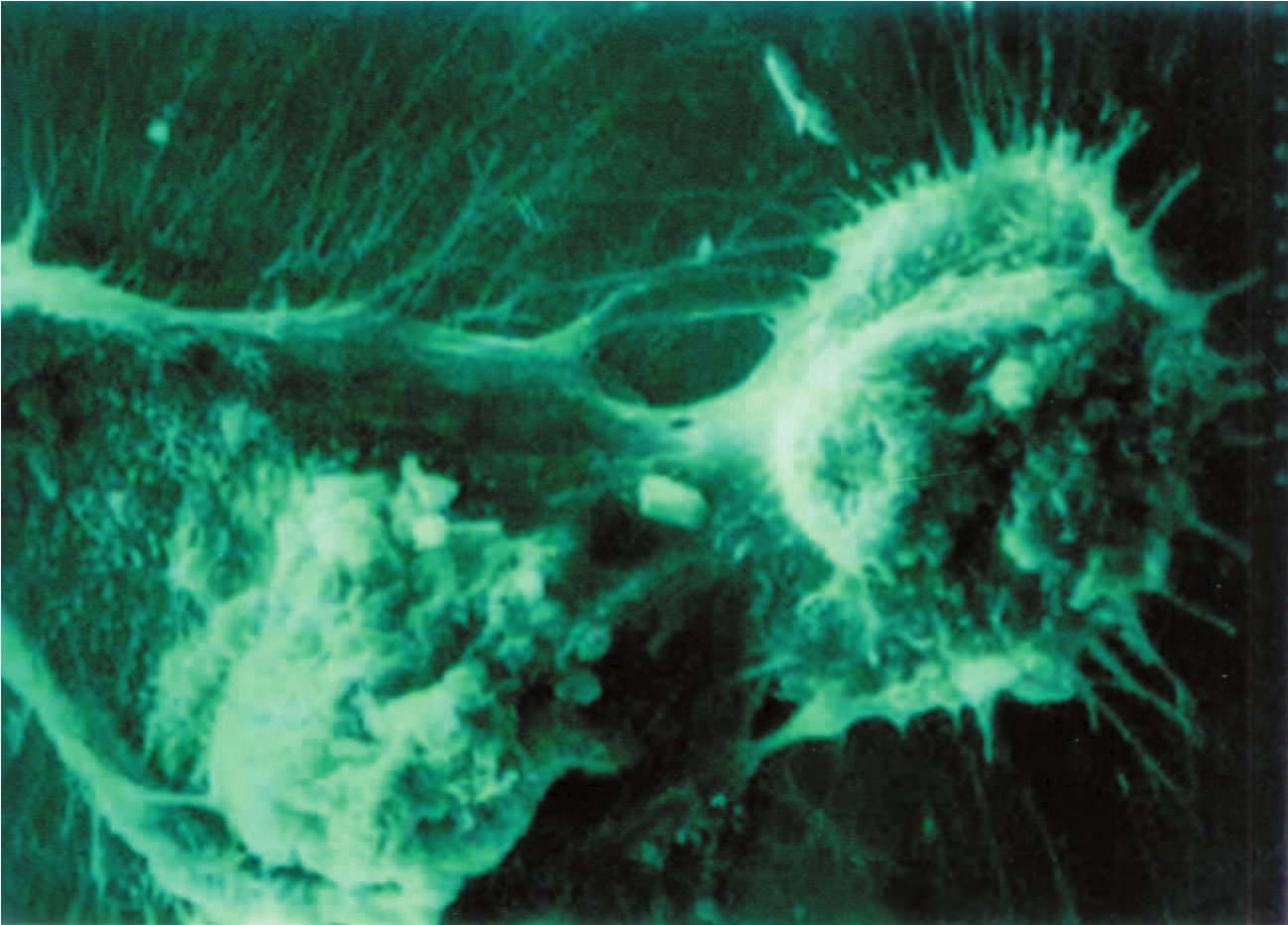
▲图1-15 体外培养的系膜细胞(SEM ×1 500)
系膜细胞表面凹凸不平,有大量丝状突起,且相互连接
2.肾球囊肾球囊,又称鲍曼囊(Bowman capsule),呈现为一个如杯状的球形小囊。正如前述,其囊壁的一部分(脏层上皮)构成毛细血管周边部,即滤过膜的一部分,其余囊壁则内衬扁平上皮,也即壁层上皮(parietal epithelium)(图1-7),胞质内含有肌动蛋白微丝,表面可形成若干微绒毛和中心纤毛,于尿极处其上皮突然过渡至肾近端小管起始部的高柱状上皮细胞。肾球囊还包括多层球囊基膜(capsular basement membrane),或称壁层基膜(parietal basement membrane),且彼此间被透明空隙所分割。近年研究发现,肾球囊基膜也含硫酸乙酰肝素蛋白聚糖和Ⅹ、Ⅳ型胶原,并分别对肾球囊储尿功能起重要作用。在肾小球尿极处肾球囊基膜转化为肾近端小管基膜,而在血管极处则转化为肾小球毛细血管基膜。
(三)泌尿小管
正如前述,泌尿小管包括肾小管和集合管。肾小管又分为近端小管、细段和远端小管;集合管系则包括始段集合小管、集合小管和集合管,并最终开口于肾乳头。
1.肾小管(renal tubule)
肾小管各段均由内衬单层上皮和小管基膜(tubular basement membrane,TBM)及少量网状纤维组成。
1)近端小管(proximal tubule)为肾小管中最长、最粗的一段,根据其形态结构,主要分为曲部和直部两段。①近端小管曲部:简称近曲小管,镜下显示管腔小而不规则,呈锯齿形,内衬上皮细胞,呈体积较大的立方或锥体形,细胞界限不清,胞质呈强嗜伊红性,核大而圆,位于基部胞质,着色浅,核仁明显(图1-16)。细胞基底部形成纵纹,其游离面有刷状缘。电镜显示上皮细胞的游离面有密集、细长的微绒毛(即为刷状缘)(图1-17)。后者表面为一层含有细胞糖萼的衣覆盖,并通过一种称为36的因子扩展其顶端的质膜,后者又含有多种酶、离子和可渗性转运因子,这些结构均为其高效的重吸收功能提供了解剖学基础。基底部的细胞膜向内凹陷,形成许多质膜内褶,胞质内含有大量线粒体。相邻的细胞间形成如交叉指状的胞质侧突,其细胞基底部的侧突可伸入相邻细胞的内褶的空隙内,故致光镜下细胞分界不清。含有Na+- K+- ATP酶的基底部质膜同样被一种称为36的因子所放大,这与该小管活跃的Na+转运功能密切相关。细胞顶部形成内褶的质膜可被一种状如网格样的蛋白结构,即gp330(megalin)所包被,这种蛋白即为大鼠Heymann肾炎抗原,而胞质常含有许多小管、小泡、大泡结构,还含有大量溶酶体、吞噬体和多泡体,以及丰富的光面内质网、少量粗面内质网和一些游离核糖体、高尔基复合体及微体等。由gp330包被的细胞顶部的凹陷、胞质内丰富的吞噬体和许多空泡所组成的这一特殊形态结构,恰与其执行的复杂的内吞功能(如白蛋白吸收)相适应。②近端小管直部:简称近直小管,构成髓襻降支的粗段(图1-18)。近直小管的结构与近曲小管基本相似,但其上皮细胞稍矮,管腔略大,微绒毛略短,细胞侧突及质膜内褶不够发达。顶部胞质的小管、小泡、线粒体以及溶酶体和吞噬体较少,而微体数量较多。肾球囊内的滤液流往近端小管过程中,内含85%以上的Na+、水,全部的小分子蛋白、多肽、氨基酸和葡萄糖,50%的碳酸氢盐、磷酸盐和尿素及维生素等被重吸收。此外,还通过分泌或排泄的方式将体内的一些代谢终末产物,如尿酸、肌酸和肌酐及某些药物或化学物质,如青霉素、酚红和有机碘化物等排出体外。
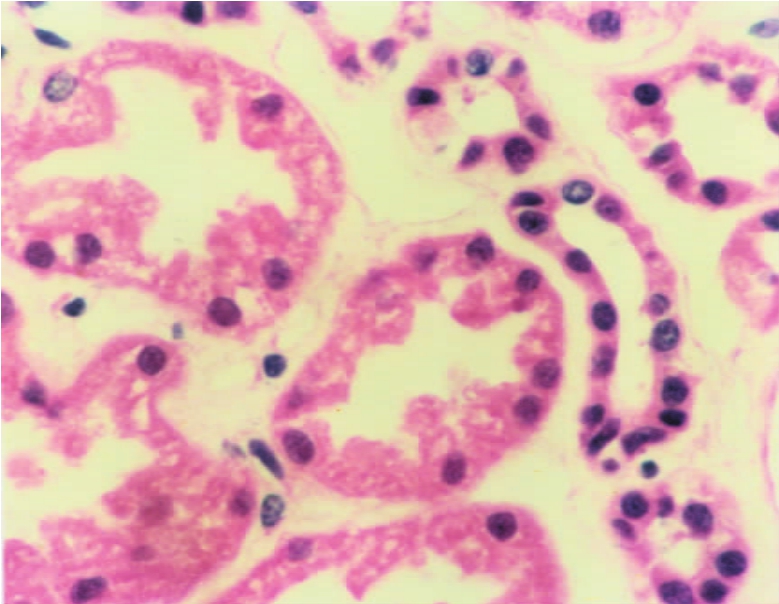
▲图1-16 肾皮质小管(HE ×400)
图左侧为近端小管,细胞体积大,胞质嗜伊红性强;图右侧为远端小管,细胞体积小,呈立方形
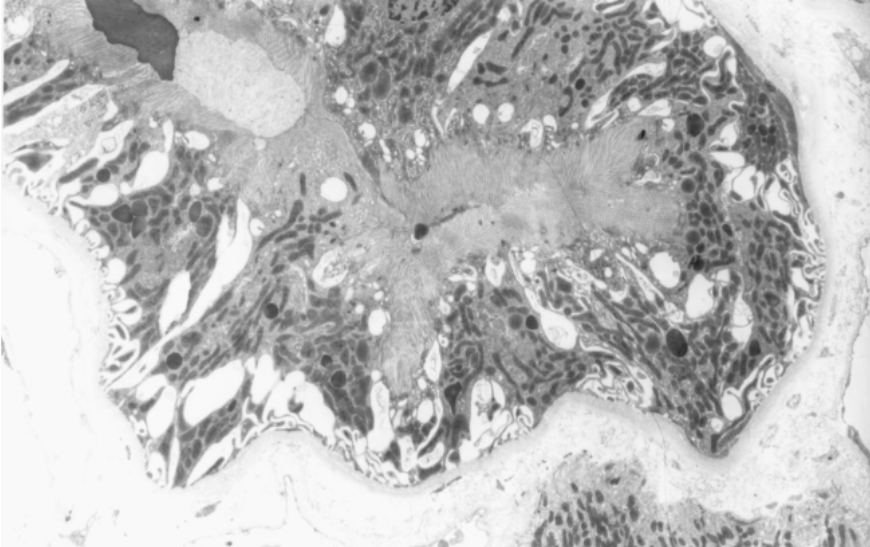
▲图1-17 肾近端小管(EM ×2 250)
上皮细胞胞质内富含线粒体,其顶端形成大量微绒毛,即刷状缘
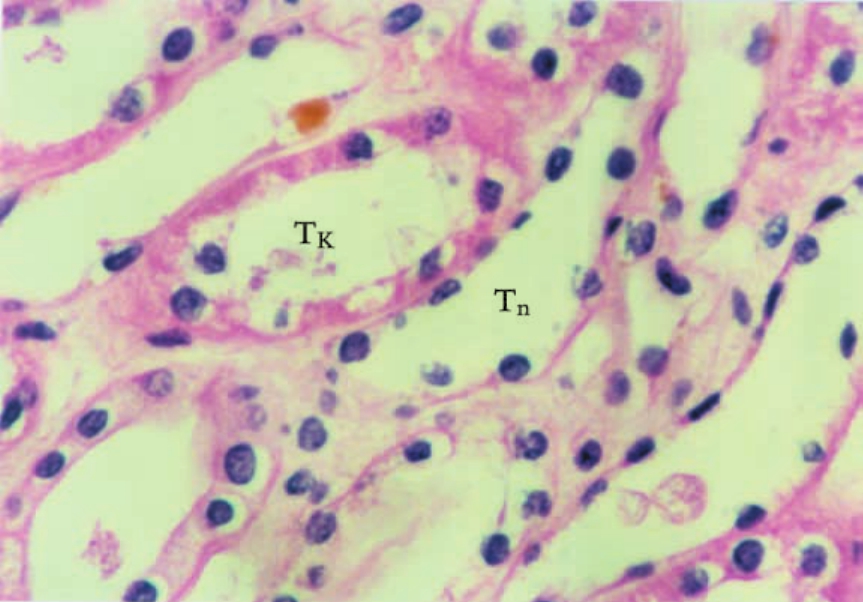
▲图1-18 肾髓质小管(HE ×400)
髓襻升支粗段(Tk)和降支细段(Tn),前者上皮细胞呈立方形,后者呈扁平形
2)细段(thin segment)又称中间小管,构成髓襻第2段。细段的管径较小,由单层扁平上皮组成(图1-18),厚为1~2 μm,细胞胞质清晰,含核部分突入腔内,其游离缘无刷状缘,微绒毛短而细。在电镜下,其细段上皮可分为4型,即Ⅰ、Ⅱ、Ⅲ、Ⅳ型。对其结构和功能的关系不完全清楚,但一致认为其在保持肾髓质的高渗和尿液浓缩机制中起重要作用。
3)远端小管(distal tubule)与近端小管相比,在组织学上有以下几个特点:①较短,因而在组织切片中,其断面较少;②上皮细胞较矮,通常为立方形,体积较小,故管腔面积相对较大(图1-16);③细胞游离缘无刷状缘;④细胞胞质的嗜伊红性不强,染色较浅;⑤细胞核靠近管腔面。远端小管可分为直部(包括致密斑)和曲部两个部分。
(1)远端小管直部简称远直小管(distal straight tubule),构成髓襻的第3段,即髓襻升支粗段。远直小管细胞的游离面有少量微绒毛及1~2根纤毛。质膜的内褶发达,细胞侧面的侧突广泛,细胞内线粒体丰富,呈长形的线粒体主要分布于侧突和褶间胞质内,其方向与细胞纵轴一致。细胞顶部有体积较小的线粒体、多泡体、溶酶体,还有多量粗面和光面内质网、高尔基复合体。
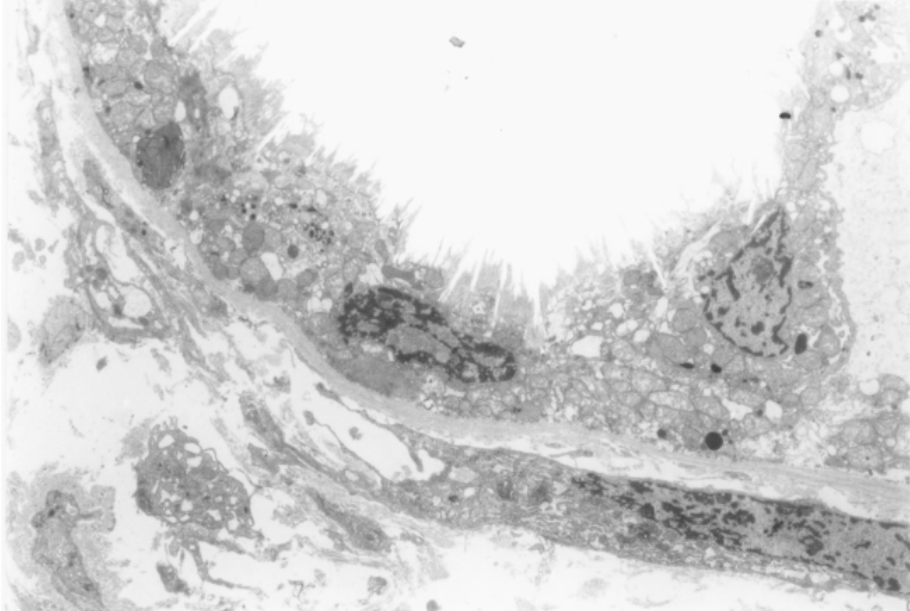
▲图1-19 肾髓质小管(EM ×3 000)
小管上皮细胞呈立方形,胞质内线粒体较少,顶端微绒毛少而短
(2)远端小管曲部简称远曲小管(distal convoluted tubule),通常位于所属肾小球周围,其长度远不如近曲小管,管腔口径不一。其组织学及超微结构形态与远直小管大致相似,其不同之处在于细胞略高,胞质清亮,电镜显示细胞游离缘微绒毛较多(图1-19)。远直小管的主要功能是重吸收NaCl,同时也参与Ca2 +的重吸收,而对水则相对不通透,故在维持机体无机离子的动态平衡中起重要作用。
2.集合管系
集合管系(collecting duct system)是由连接小管(connecting tubule)和集合管(collecting duct)组成,全长20~20 mm,最长者可达38 mm。连接小管为连接远端小管和集合管之间的一段小管,位于肾皮质迷路。浅表肾单位的连接小管单独汇入集合管,而皮质中层、髓质旁肾单位的连接小管先汇合成弓形集合管,再汇入集合管。集合管位于髓放线内,途经外髓和内髓时(称为髓质集合管),它们会不断地相互合并,在近肾小盏处汇集成管腔较大的乳头管,后经乳头开口于肾小盏。
集合管系的管径由起始部的40 μm到乳头管处的200~300 μm,其内衬上皮自低立方状至乳头管处的高柱状。光镜下显示其细胞胞质透亮,几乎不着色(与细胞器稀少有关),细胞界限十分清晰(图1-20)。电镜下显示细胞游离面微绒毛稀少而短小,几无胞膜内褶和侧突。细胞间尚可见一种电子密度较高的细胞,称闰细胞或旁细胞,它们至少可分为A、B两型,两者可能分别与H+、HCO-3分泌或重吸收有关,且随机体酸碱状态的改变而互相转换,以调节机体的酸-碱平衡。
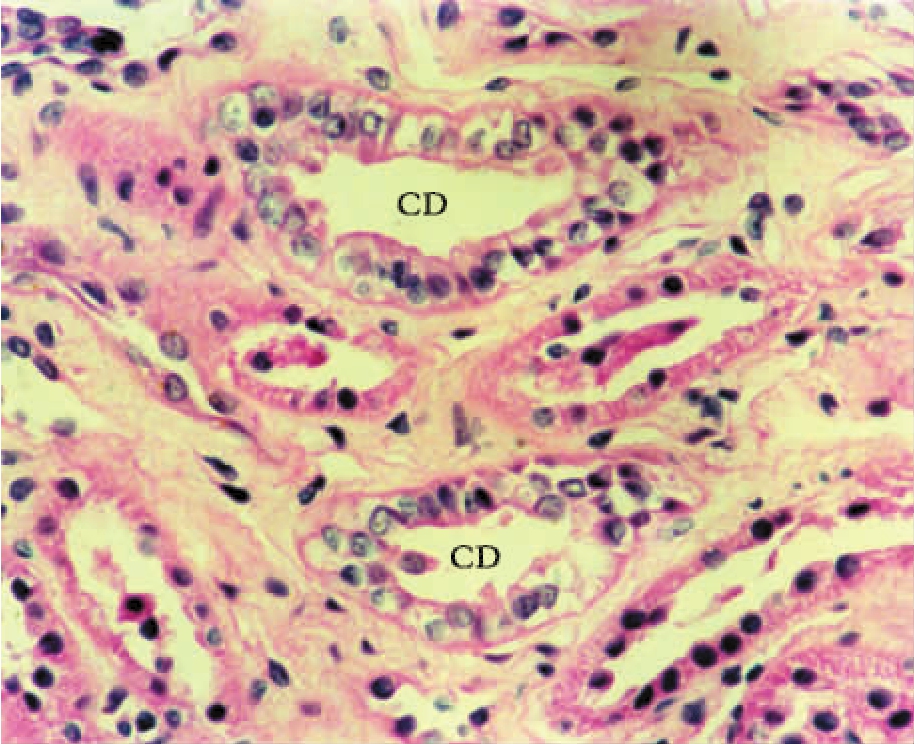
▲图1-20 肾髓质小管(HE ×200)
两集合小管(CD)上皮细胞体积较大,呈高柱状,胞质透亮
集合管的主要功能是参与尿液浓缩、酸化和对机体酸-碱平衡的调节。其中对水的通透性受抗利尿激素的调节,后者可促使上皮对水的通透性增加,使管液中小分子物随其渗透作用而进入呈高渗状态的髓质,使尿液达到浓缩。集合小管上皮(与远端小管上皮一样)重吸收钠和分泌钾的作用受醛固酮的调节,后者的作用包括:①加强上皮细胞的钠泵作用;②增加膜对Na+的通透性;③增强细胞线粒体内ATP的生成。这些作用都可促进Na+在肾小管和集合管上皮的重吸收,从而发挥其对机体保钠排钾及酸化尿液的作用。
(四)肾球旁器
肾球旁器,又称球旁复合体(juxtaglomerular apparatus,JGA),由致密斑、球旁细胞和球外系膜细胞三者组成,位于肾小球血管极处、略呈三角形的区域内(图1-7)。
1.致密斑(macula densa)位于肾小球血管极处的远直小管,一侧的上皮细胞变成细长高柱状,排列紧密,且在该处形成一个呈椭圆形的隆起,直径40~70μm,称为致密斑。每个致密斑共有20~30个细胞构成(图1-21)。其上皮细胞在电镜下显示其游离面有微绒毛和短而不规则的皱襞,偶见单根纤毛。相邻细胞顶部有紧密连接,侧面有指状突起相嵌,基底面有内褶,核常靠近细胞底部,高尔基复合体在其下方(图1-22)。顶部胞质含有小泡,内质网和核糖体则呈散在分布。致密斑细胞间存在间隙,可流通水分等,并能随肾功能状态的不同而变大或缩小,甚至呈关闭状态。
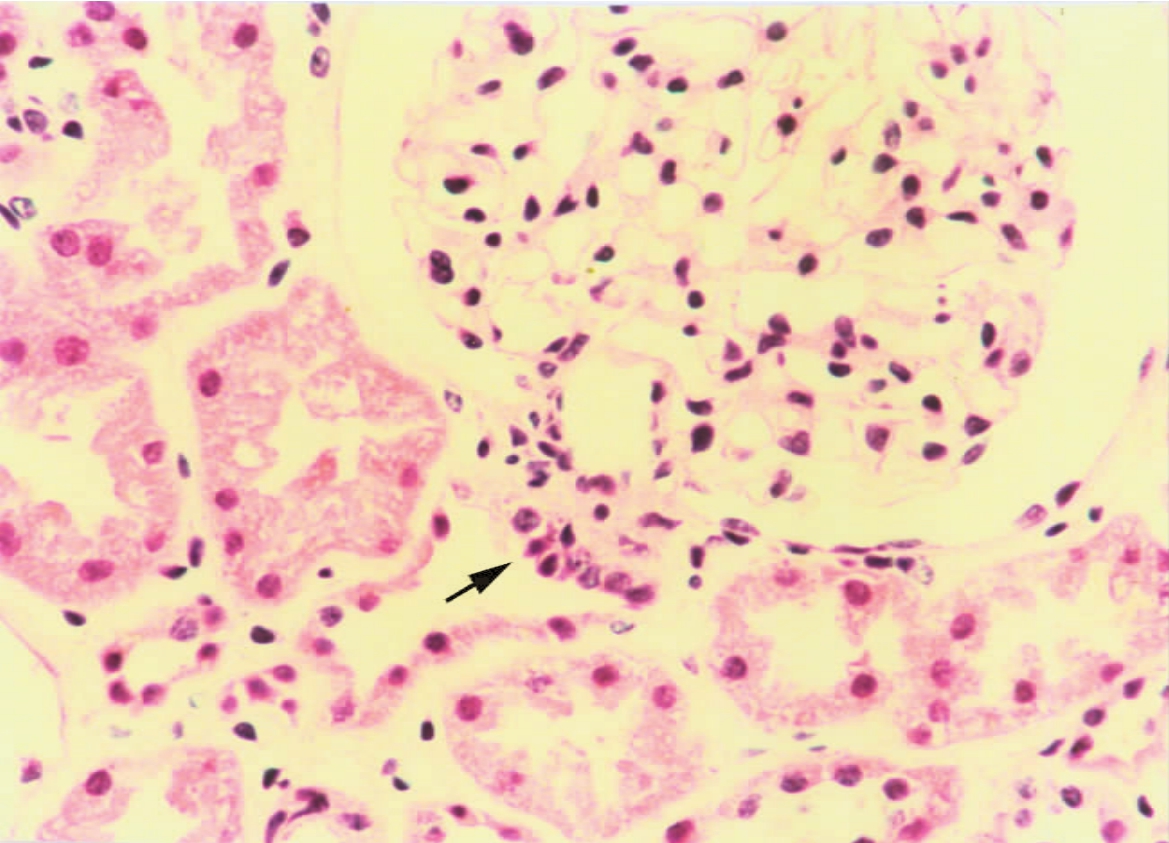
▲图1-21 致密斑(HE ×200)
近球旁一远端小管上皮细胞(↑)呈柱状,排列较紧密
致密斑的功能是感受尿钠浓度和调节肾素分泌,其机制可能是通过致密斑细胞基部的指状突起,与球旁细胞的连接或肾小球血管极与致密斑间接触面的改变而控制肾素的分泌。致密斑细胞也可经NaCl转运依赖方式,生成若干介质(如腺苷、NO和前列腺素等),调节管球平衡和肾素分泌。
2.球旁细胞(juxtaglomerular cell,JGC)由入球微动脉壁的平滑肌细胞衍化而成。球旁细胞为肌上皮细胞,呈立方或多边形,核较大,胞质丰富,呈弱嗜碱性,内含数量不等的特殊分泌颗粒,PAS染色阳性。应用免疫组化法证实其颗粒内含有肾素。电镜可显示胞质内有中等量粗面内质网和高尔基复合体,并含有特征性分泌颗粒,有膜包被,大小不等,直径平均约500 nm,呈圆形、椭圆形或菱形(图1-23)。该细胞以出胞作用的方式释放肾素。释出的肾素多数先入肾间质,后由毛细血管或淋巴管回流进入血液,少数也可直接进入入球微动脉,再通过肾素-血管紧张素系统的作用调节机体的血压、血容量和电解质的平衡。
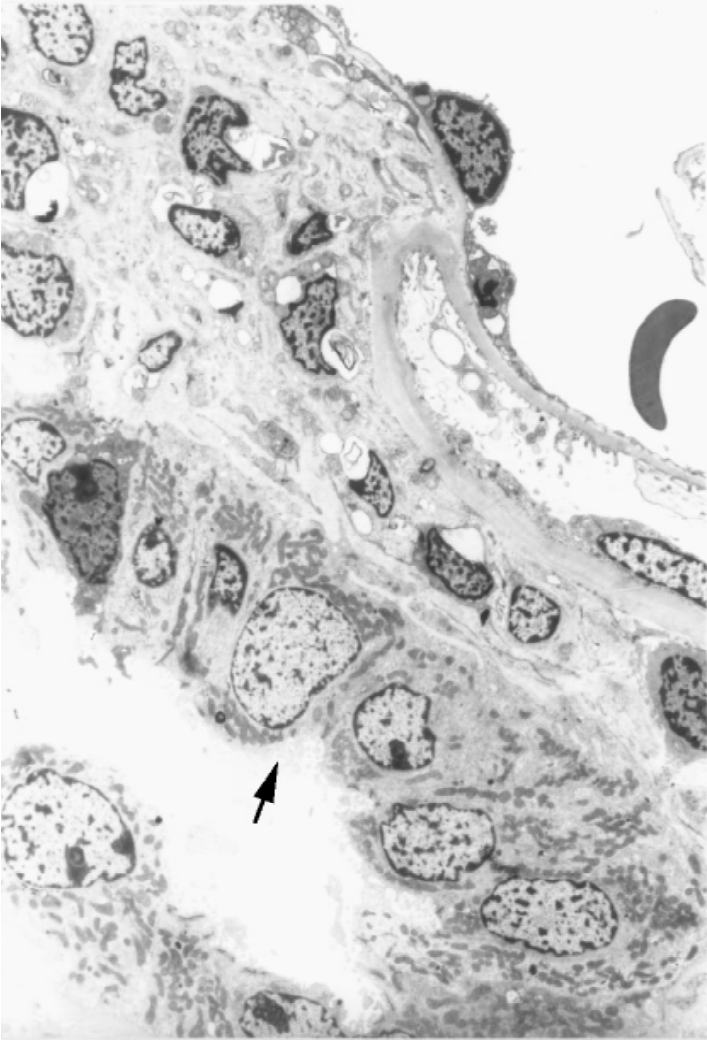
▲图1-22 致密斑(EM ×2 250)
致密斑(↑)上皮细胞呈柱状,紧密排列,胞质富含线粒体
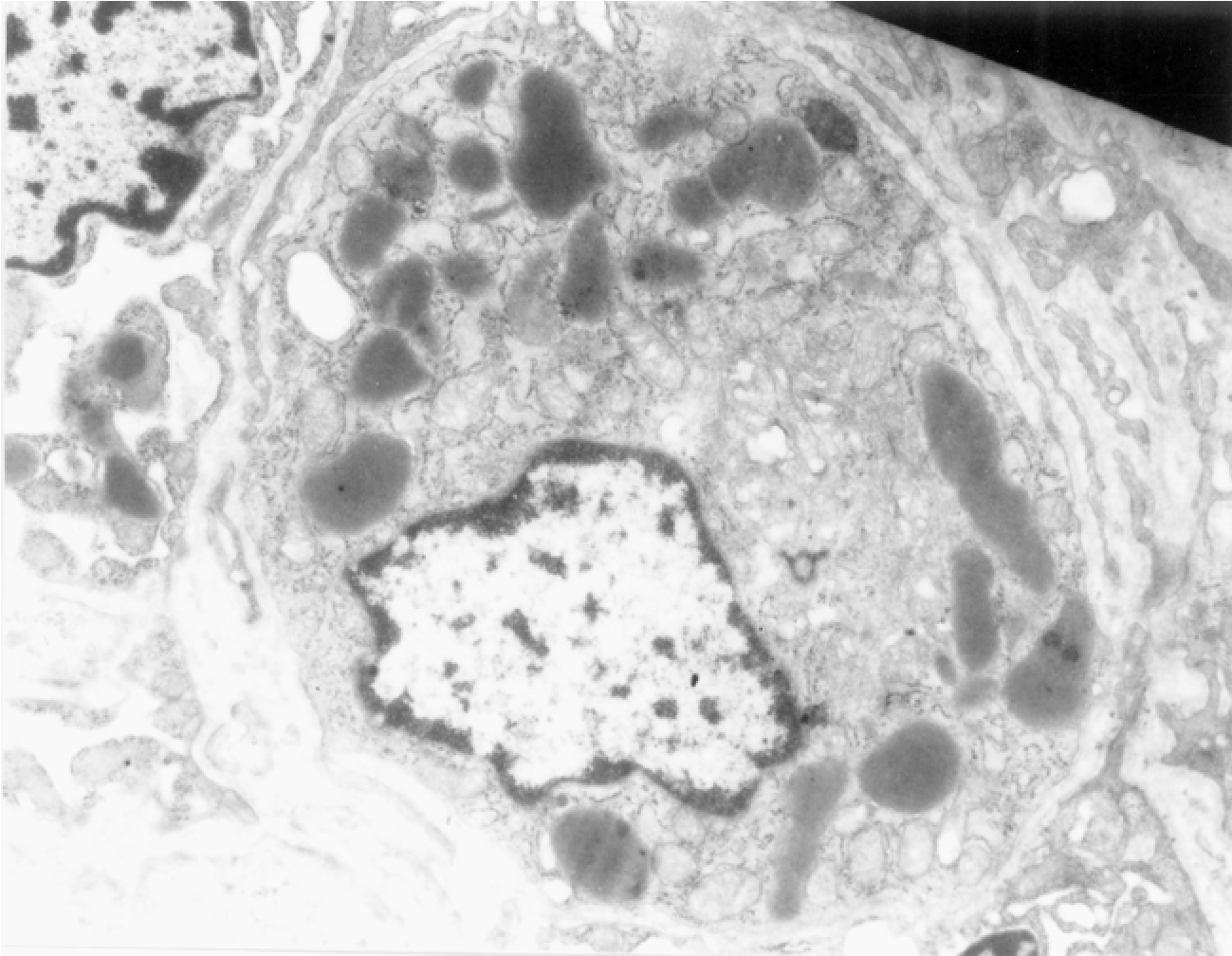
▲图1-23 球旁细胞(EM ×7 500)
球旁细胞胞质内含有呈圆形、椭圆形或不规则菱形的分泌颗粒
3.球外系膜细胞(extraglomerular mesangial cell)指位于肾小球入球微动脉和出球微动脉之间的一群细胞,又称网格细胞(Lacis cell)或极垫细胞(polar cushion cell)。它与球内系膜细胞呈连续性分布。该类细胞体积较小,胞质着色浅,细胞表面有突起,细胞器稀少(图1-24,1-25)。电镜显示胞质内有粗面内质网、高尔基复合体以及少量分泌颗粒。球外系膜细胞可经缝隙连接与JGC、球内系膜细胞和微动脉平滑肌细胞广泛接触,又与致密斑紧密相贴,因此它可能在致密斑与上述效应器之间起某种信号传递的功能。在某些因素刺激或病理情况下,球外系膜细胞可转变为具有肾素颗粒的细胞,也可发生增生和肥大。
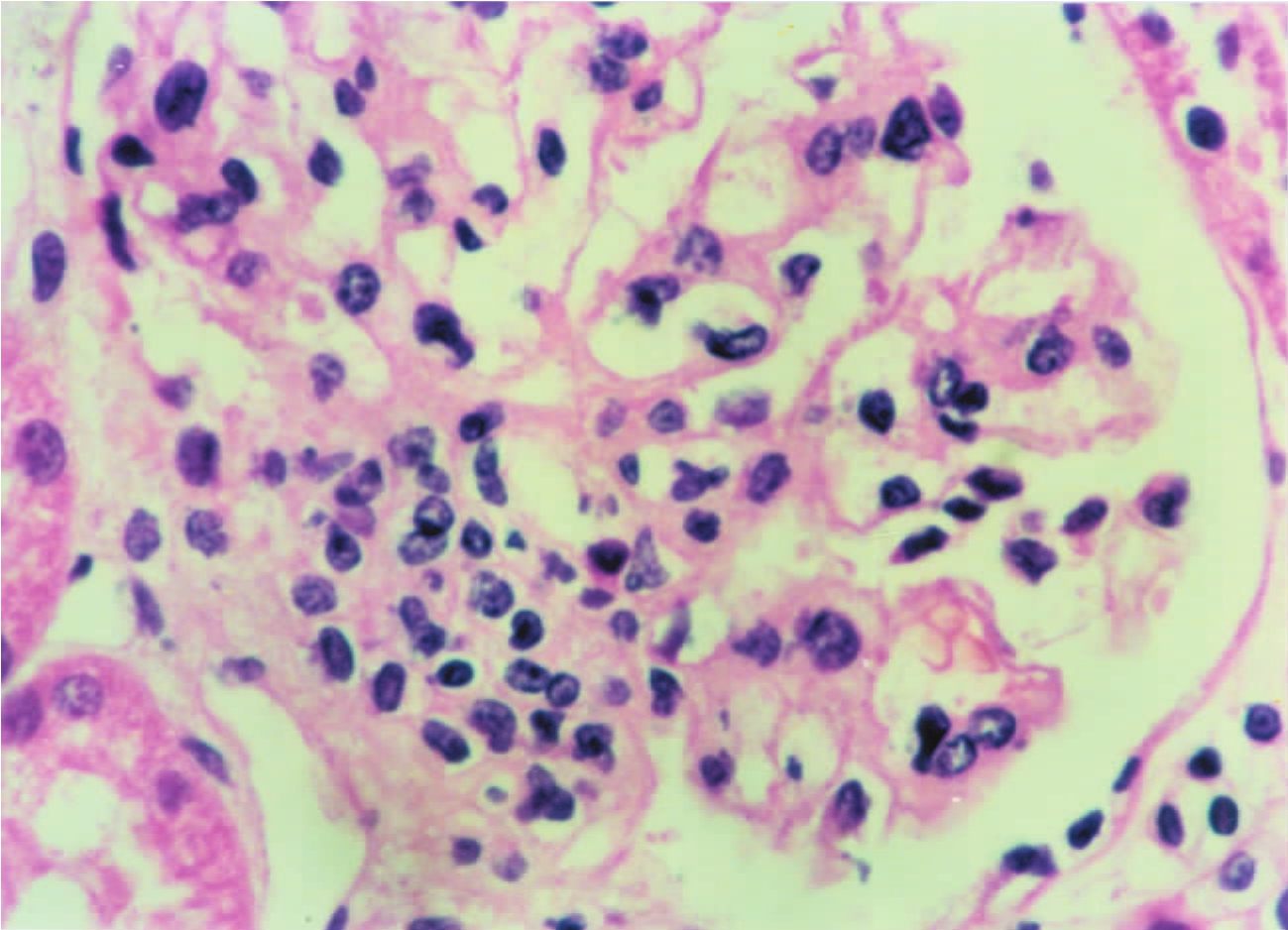
▲图1-24 球外系膜细胞(HE ×400)
聚集成堆的球外系膜细胞分布于肾小球门处
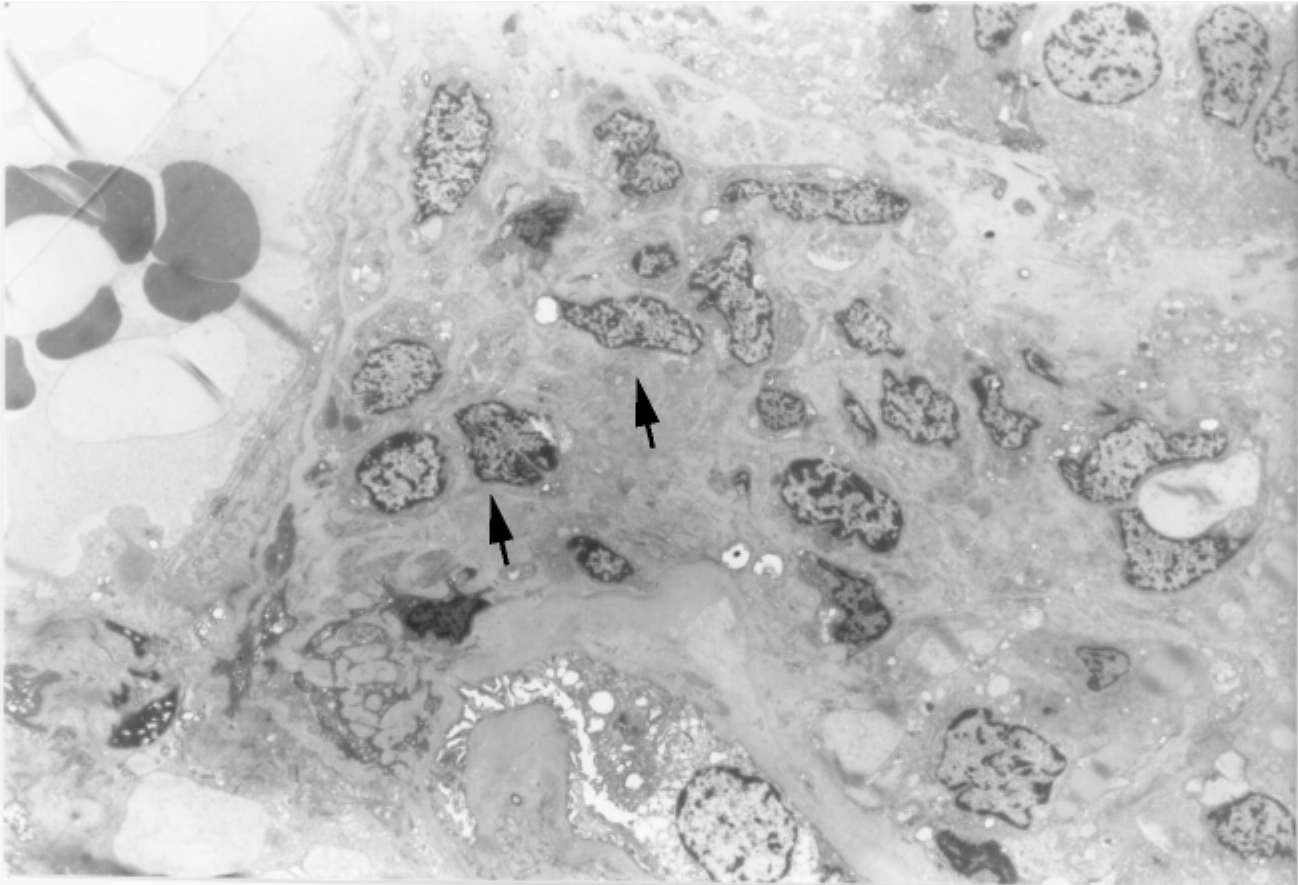
▲图1-25 球外系膜细胞(EM ×1 500)
聚集成堆的球外系膜细胞(↑)分布于肾小球门处
(五)肾间质
肾间质(renal interstitium)通常指肾单位、集合管系和血管之间存在的少量结缔组织。正常肾的肾间质以髓质部,尤其是内髓、肾乳头部较为丰富,主要由纤维、基质和间质细胞组成。纤维以胶原纤维(Ⅰ、Ⅲ、Ⅵ型)和网状纤维为主,胶原纤维在肾皮质分布于肾小球、肾小管和肾血管周围,在髓质部则以肾小管和血管周围为多,而网状纤维往往与肾小管、肾球囊基膜相融合。基质可分为糖胺聚糖(主要为硫酸乙酰肝素、硫酸皮肤素和透明质酸等)和间质液(水、溶质)。依据Bohman的分类,间质细胞可将其分为Ⅰ、Ⅱ和Ⅲ型。目前确认,同一类型的间质细胞(如I型)可呈现不同性质和功能的细胞。
1.成纤维细胞(fibroblast cell)属Ⅰ型间质细胞,是皮、髓间质的主要细胞,数量多,细胞形态较长,有薄而长的突起,并有分支,相邻细胞间经中间连接样结构相互连接,构成一个呈三维结构的细胞网,其突起也可与TBM或毛细血管基膜相接触。细胞核呈圆形或椭圆形,胞质内有丰富的粗面内质网、高尔基复合体,且含有线粒体和溶酶体,偶见脂滴。胞质和突起内微管微丝与细胞或突起长轴呈平行排列。近年证实,在小管周围有一种成纤维细胞含有胞外-5'核苷酸酶活性,且同时表达红细胞生成素mRNA,在贫血和低氧条件下,发现两者表达或活性增强,提示其能合成红细胞生成素。
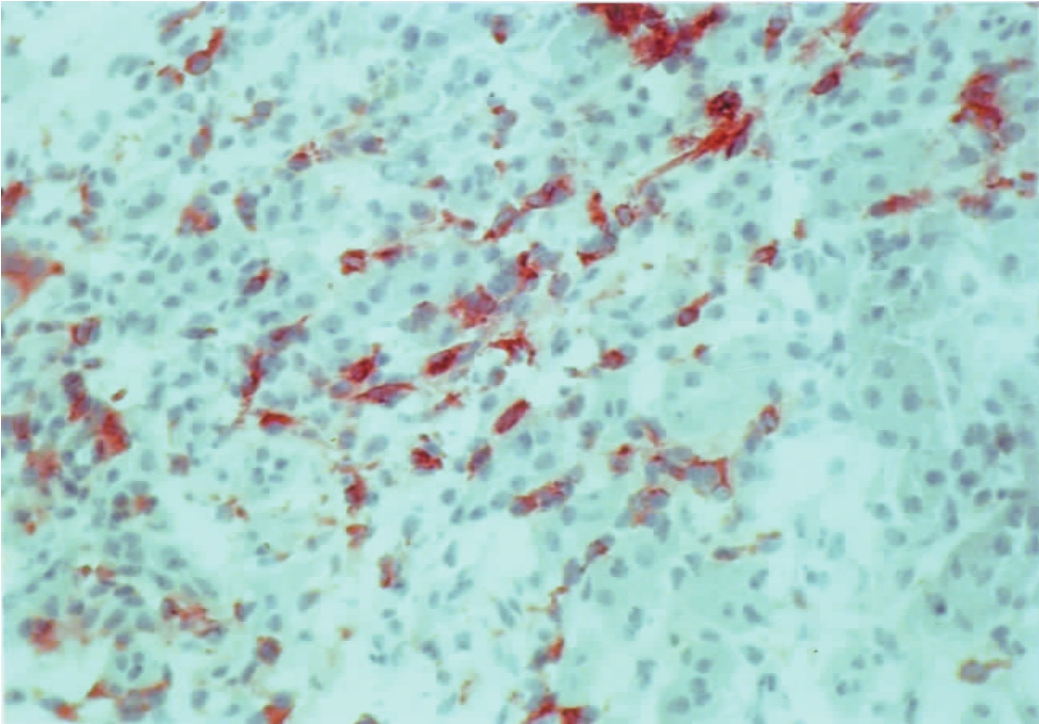
▲图1-26 肾间质树突细胞(IH ×200)
肾间质树突细胞MHC-Ⅱ类抗原呈阳性着色
2.骨髓源性细胞(bone marrow-derived cell)包括树突细胞、巨噬细胞和淋巴细胞。Ⅱ型间质细胞即为巨噬细胞。正常的间质内,大多数表面携有主要组织相容性复合物Ⅱ类(MHC-Ⅱ)抗原的细胞属于树突细胞。细胞呈星状,免疫组化显示MHC-Ⅱ类抗原阳性(图1-26),是肾间质内的抗原呈递细胞,常与成纤维细胞紧密相伴。巨噬细胞的数量较少,多呈圆形,表面有微皱褶。当其被激活时,皱褶增加。其功能主要为吞噬作用和参与髓质糖胺聚糖的降解。
3.载脂间质细胞(lipid-laden interstitial cell)也属Ⅰ型间质细胞,多分布于肾髓质。细胞胞体较长,多呈不规则或星状,形成许多突起,后者可与多根毛细血管和髓襻相连,胞质内有特征性的嗜碱性脂滴,数量不一(图1-27)。胞质内有丰富的粗面内质网、高尔基复合体、溶酶体、吞噬体和管泡状结构,其线粒体常呈短杆状。胞体周边及突起内富含微管、微丝。该细胞功能多样,包括生成纤维、基质、前列腺素(PGE2、PGI2、PGF2a等)、抗高血压极性脂和中性脂等;依赖其收缩功能可促进血管内血流加快、尿液浓缩;具有吞噬功能,可吞噬各种异常物质等。
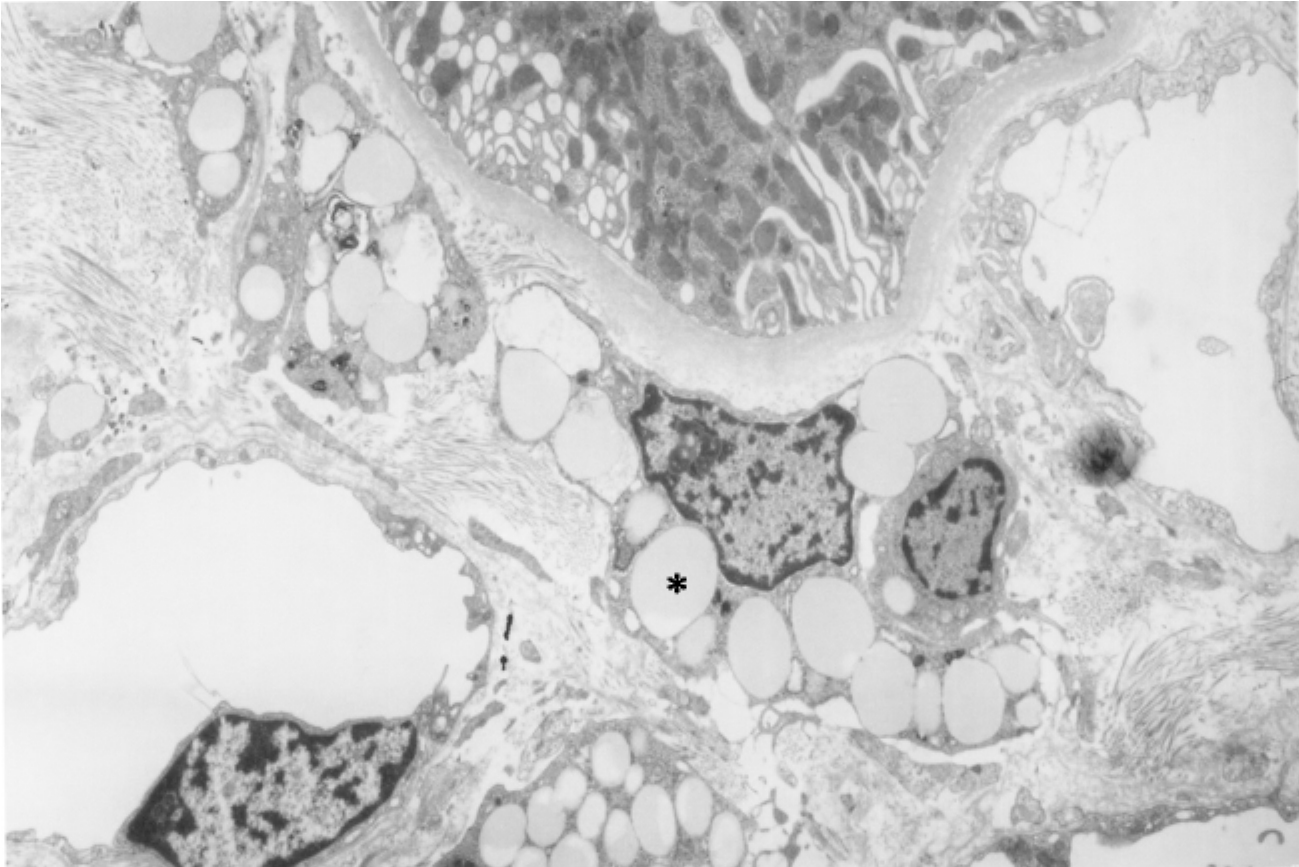
▲图1-27 肾载脂间质细胞(EM ×3 750)
肾间质内多个载脂间质细胞,其胞质内富含脂质空泡(*)
4.血管周细胞(vascular pericyte)属Ⅲ型间质细胞,呈扁平状(图1-28),多位于髓质外直小管降支和毛细血管基膜外,也可见于出球微动脉和小管周围的毛细血管旁。
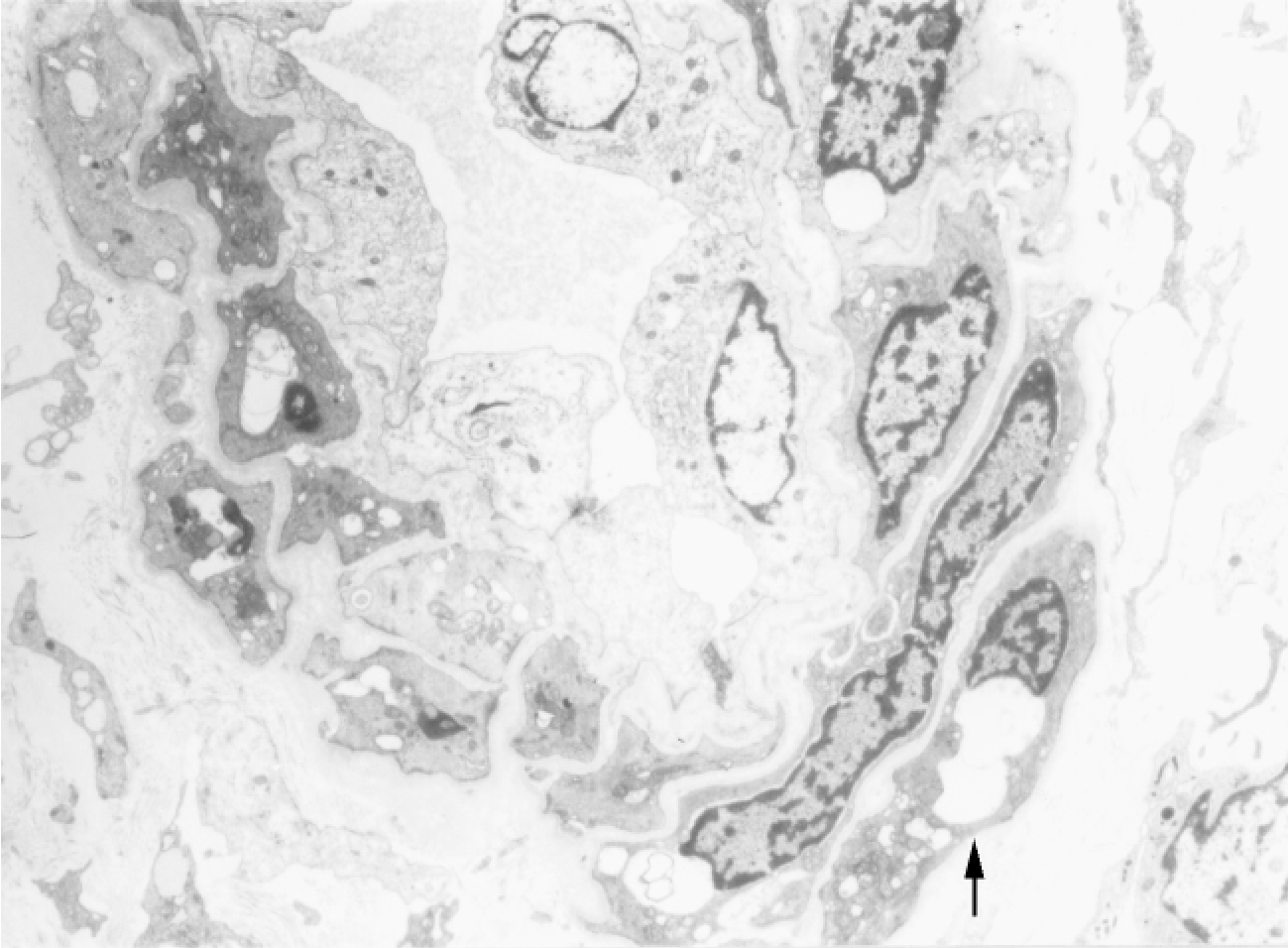
▲图1-28 血管周细胞(EM ×3 750)
肾微动脉旁有呈梭形的血管周细胞(↑),胞质内有空泡形成
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















