自南极臭氧空洞被报道以来(Farman et al.,1985;Crutzen,1992),人们对UV辐射增强所导致的生态环境破坏问题极为关注。UV-B辐射的增加使南极水域上层10~20m内的光合作用减少了25%(Malanga&Puntarulo,1995)。美国宇航管理局(NASA)根据其1988年的测算(Correia et al.,1998),发现从1969—1988年20年间全球臭氧层的总量减少了1.7%~3.7%,南极地区减少了50%,并且这种减少还在加剧。由于氯氟烃等的大量使用,使排放到大气中的氯氟烃以及其他氮氧化物(如N2O等)增加,引起臭氧层的破坏,已成为人类面临的重大环境问题之一。
紫外线按其波长大小分为:UV-A(波长范围为320~400nm)、UV-B(波长范围在280~320nm)以及UV-C(波长范围为10~280nm)。由于臭氧层变薄而到达地面的UV-B辐射增加,虽然其在太阳短波辐射中所占量较小,但却能有效地被一些生物大分子,如核酸、蛋白质等物质吸收,从而造成对生物的伤害。在此也主要介绍UV-B辐射对藻类的影响。
为了证明UV辐射的变化,很多研究者设计出各种有意义的途径。在光保护性可溶、有机碳含量很低的水体环境中,太阳光中的UV辐射便可伤害有机体(Bothwell et al.,1994;Karentz et al.,1994;Siebeck et al.,1994),这些有机物可能与酸雨和气候变化无关(Schindler et al.,1996;Yan et al.,1996)。气象和生物监测没有记录下UV辐射量的变化及其对环境的影响,由于藻体中的色素在湖泊沉积物中能够得到很好的保存(Leavitt,1993),Peter等(1997)认为可以用湖泊沉积物中的某些色素化石来证明环境中UV辐射的变化情况。
(一)UV辐射对藻类的影响
土壤藻营光合自养,太阳光是其主要的能量来源,且干旱、半干旱地区的土壤藻直接暴露在大气中,UV辐射的增强必将影响土壤藻的生长、发育和繁殖。在紫外线辐射中,研究得比较多的是UV-B辐射,它具有极强的生物破坏性,能抑制或阻止藻类的一系列生态、生理和生化过程,如破坏藻体的蛋白质、DNA和其他相关生物分子(Crutzen,1992),影响藻类的生态分布、现存量、存活率、生长速率、膜通透性、色素组成、藻胆蛋白的装配、碳源的转化、固氮以及运动能力等(Donkor&Káder,1991;Sinha et al.,1995、1996)。
(二)UV辐射对藻类的损伤机制
1.对生物量的影响
在UV-B增强条件下蓝藻的生长受到抑制,存活率显著降低(Gourr et al.,1997;Suresh et al.,1998;Araoz et al.,1998a)。Suresh等(1998)曾用UV-B处理Nostoc sp.,Anabaena sp.和Scytonema sp.,发现各自生长速率分别下降28%、30%和36%,干重分别下降12%、27%和10%,表明不同藻种对UV-B的敏感性存在差异。UV-B剂量越高,藻细胞存活率下降更加显著。Araoz等(1998a)用50kJ·m2的UV-B处理Nostoc sp.,发现其存活率下降60%。Araoz等(1998b)用相当于臭氧层正常的中纬度地域照射6h剂量的15kJUV-A和15kJUV-B处理Nostocmuscorum,其存活率只有3%。经4W/m2的UV-B照射Anacystis nidulans4h,其存活率不及对照的30%(Gourr et al.,1997)。
UV-B辐射导致蓝藻生物量降低的原因主要是UV-B破坏光系统,使得蓝藻的净光合速率降低,进而导致其光合产物积累减少;另一个原因可能是UV-B辐射影响细胞分裂和细胞伸长,导致生长速率降低(Preusss&Britta,2003;Hpknal et al.,1996)。
2.对蛋白质的损伤
蛋白质不仅是生物有机体的重要组成成分,而且作为生物催化反应的酶类(如Rubisco和ATP酶等)在各种生理代谢中发挥重要作用。
UV-B辐射引起蛋白质结构发生改变。构成蛋白质的20种氨基酸中,色氨酸、酪氨酸、脯氨酸和组氨酸富含芳香环或杂环,这些芳香环和杂环中的共轭双键对UV-B有强烈的吸收。这些基团在吸收UV-B之后转变为具有很强氧化性的激发态,这种激发态极易发生开环或与其他物质直接结合,而使蛋白质分子的空间结构发生改变,从而失去原有的生物活性(姜海波等,2005)。色氨酸等在光降解的同时会诱导产生活性氧自由基,而活性氧自由基可以直接修饰蛋白质,而可能对光合作用等代谢过程的酶产生抑制(Pintome et al.,1999)。蛋白质还可被UV-B辐射做出其他响应,包括—SH基的修饰、提高膜蛋白在水中的溶解度、促进多肽链的断裂等,这些修饰也可引起酶的失活和蛋白质结构的改变(Bredt et al.,1991;Sauter et al.,1993;Quaite,1994)。
对UV-B辐射在增加还是减少植物蛋白质含量方面存在不同的观点。UVB辐射可抑制蛋白质的合成,导致蛋白质降解、变构以及酶活性的丧失(Araoz et al.,1998a;Quaite et al.,1992)。Santos(1993)和Basiouny等(1978)也认为UVB辐射使植物的蛋白质含量减少。Tevini等(1981)则认为UV-B辐射使某些植物的蛋白质含量减少,而使另一些植物的蛋白质含量增加。Tevinim(1981)也认为UV-B辐射会使植物的蛋白质含量上升,蛋白质含量的上升可能是由于芳香族氨基酸是合成类黄酮的前体物质,而类黄酮有利于保护植物免遭UV-B辐射的伤害。与高温对蛋白质的作用不同,UV-B显著抑制蛋白质的翻译,同时诱导产生一种分子量为18kD的蛋白,该蛋白是由UV-B诱导蛋白质多肽链发生交联形成的。
蛋白质代谢是否正常,直接影响藻细胞的光合作用。可溶性蛋白质中约有50%是Rubisco,可溶性蛋白质含量的下降会导致植物Rubisco活性和光合能力的降低(Strid,1993)。也有人发现UV-B导致Rubisco和ATP酶活性下降(Pintome et al.,1999;Takeuchia et al.,2002)。这些重要蛋白质的变构或降解导致藻细胞光合作用受到抑制,生长速率下降。蓝藻光系统Ⅱ(PSⅡ)的D1蛋白对UV-B极为敏感,大量研究表明UV-B辐射导致D1蛋白的光降解,从而导致PSⅡ功能的下降(Frisog et al.,1994;Kollib et al.,1998)。
藻体可通过对蛋白质及核酸代谢的调节来适应短期增强的UV-B辐射。一方面,UV-B辐射可诱导一些抗性基因的表达,表达的增强以保护藻体免遭伤害;另一方面,藻体可通过提高光复活酶等的活性来修复由于UV-B辐射所引起的伤害。当低剂量的UV-B辐射引起藻体内修复机制过分活跃时,反而会刺激藻细胞的生长。编码光合作用的一些关键酶的基因极易被UV-B辐射所抑制,从而导致藻体光合能力的下降,并抑制藻体的基因表达。此外,由于UV-B辐射会引起蛋白质的结构发生改变,特别是蛋白质的结构发生改变会影响整个膜系统,其结果必然会改变在膜上进行的各种生理生化过程。膜结构被破坏后,一方面会导致DNase和RNase从细胞的区隔中释放出来,致使DNase和RNase的活性上升;另一方面会导致蛋白质对内源蛋白水解酶的活性上升。UV-B辐射处理下DNA和RNA合成能力的被抑制及核酸水解酶活性的上升会促使其提前衰亡,这可能是UV-B辐射抑制藻体的生长、降低生物量的最根本原因(陈坤等,2004)。
3.对DNA的损伤
UV-B引起基因转录本的减少和RNA活力下降(Jordan et al.,1998)。DNA分子中的碱基也含有杂环(嘧啶环和嘌呤环),这些基团尤其是嘧啶环吸收UVB后,跃迁到具有很强氧化活性的激发态,并引发一系列反应。一是相邻嘧啶环结合形成二聚体,如形成环丁烷嘧啶二聚体(CPD)、嘧啶(6-4)嘧啶酮二聚体(6-4光产物)或胸腺嘧啶二聚体,DNA二聚体的数量随紫外线照射剂量增加而直线上升(Tevinim,1981;Hidege&Vassi,1996),或是激发态碱基与其他物质结合而脱落,引起移码突变;二是将激发态产生的高能电子传递给O2、OH-和H2 O等基团或分子,形成破坏力很强的活性氧自由基,这些自由基反过来又引起DNA分子断裂,进而影响DNA复制或导致基因突变(Karent et al.,1991)。Doanhue等(1994)也认为UV-B对DNA最主要的损伤表现在嘧啶二聚体(环丁烷嘧啶二聚体约占75%,6-4光产物约占25%)的形成,嘧啶二聚体会阻碍DNA聚合酶和RNA聚合酶Ⅱ在DNA双螺旋上的推进,从而阻止DNA的复制和转录。
UV-B对蓝藻基因表达也产生重要影响(Campbell et al.,1998;Mátéet al.,1998),尤其是PSⅡ的D1蛋白在UV-B辐射下基因表达迅速改变。蓝藻D1蛋白由psbA多基因家族编码,psbA1基因编码Ⅰ型D1蛋白(D1∶1),psbA2和psbA3基因编码Ⅱ型D1蛋白(D1∶2),D1∶2较D1∶1对UV-B具有较强的耐受性。用1.3W/m2的UV-B处理Synechococcus PCC 7942野生型细胞15min,psbA1基因表达没有变化,而psbA2和psbA3转录产物却急剧升高(Campbell et al.,1998;Takeuchia et al.,2002)。Máté等(1998)也发现在UV-B辐射下psbA2和psbA3的mRNA含量明显增加,psbA3 mRNA含量上升更为显著。UV-B辐射影响抗氧化基因的表达(Strid,1992;Willekens et al.,1994)。UV-B可导致光合基因Lhcb、Rbcs、rbch和psbA转录降低,同时增加PR21和PDF122基因的表达,这表明UV-B对于光合作用基因表达具有一定的抑制作用(Mackerness et al.,2001)。UV-B处理抑制了lox基因的表达,进而影响了lox蛋白质的合成(Mackerness,1997)。
4.对光合色素的损伤
藻类的光合色素主要包括叶绿素、类胡萝卜素和藻胆蛋白。到达藻细胞的绝大部分UV-B被叶绿素和捕光色素复合体(主要是藻胆体)吸收,因此UV-B极易伤害藻胆体和类囊体膜(姜海波等,2004)。
经UV-B处理后的藻细胞叶绿素含量明显下降(Suresh et al.,1998;Rajapopal et al.,2000)。可能是叶绿素分子吸收UV-B后导致高能电子过剩,这些高能电子不能及时地通过电子传递链传递出去,积累的能量导致叶绿素光氧化,破坏叶绿素结构,导致叶绿素分解的结果。也有人认为经UV-B处理后叶绿素含量不降反升(Monika etal.,1997)。叶绿素含量不受UV-B影响的可能原因是UV-B诱导Scytonemin、MAAs等UV保护色素合成,这些保护色素分布在藻类最外面的藻鞘中,使藻细胞免遭UV-B的伤害。
UV-B辐射降低光合色素含量和光合速率的原因可能是其诱导了叶绿素和类胡萝卜素的非酶化加氧作用,从而导致这些色素以氧合形式积累。经UV-B处理后,SOD酶活性降低,MDA积累,说明UV-B辐射使体内产生了氧自由基,发生了脂质过氧化,使体内清除自由基的能力减弱,造成光合能力下降。只有保持高水平的抗氧化代谢水平,才能有效清除活性氧,减轻膜脂过氧化,减少光合色素的降解。叶绿素的漂白与MDA的产生是同时发生的,叶绿体的脂质过氧化可能与PSⅡ的失活有关,UV-B对光系统Ⅱ的阻抑要强于对PSⅠ(Tevinim&Teramura,1989;陈坤等,2004)。
Brandle等认为UV-B辐射可导致叶绿体膜结构和超微结构的破坏。Murphy(1990)提出生物膜是UV-B辐射的作用靶。UV-B辐射可改变生物膜脂肪酸组分,导致不饱和脂肪酸含量下降,饱和脂肪酸含量上升,从而引起不饱和酸指数下降,而不饱和酸指数与膜的流动性相关(安黎哲,1997),这说明UV-B导致叶绿体膜流动性下降。叶绿体受到UV-B破坏原因可能是UV-B辐射引起活性氧代谢的紊乱,而使膜脂发生氧化作用,使膜结构受到破坏(Arnotts&Murphy,1991)。
类胡萝卜素(Carotenoid,CAR)能淬灭由UV-B诱导产生的活性氧,因而被认为是一种UV保护色素。Gotz等(1999)发现,Synechococcus PCC 7942在UVB诱导下,其CAR含量增加,同时组成发生改变,玉米黄质与β-胡萝卜素的比例增高。玉米黄质和β-胡萝卜素是其最主要的两种类胡萝卜素,玉米黄质在防止自由基导致的过氧化作用中比β-胡萝卜素更加有效(Sandmann etal.,1998),因此这种组成改变可有效防护UV-B引起的伤害。Monika等(1997)研究发现,Nostoc commune经1W/m2的UV-B辐射处理5h,其CAR含量明显增高,经24h照射后其CAR/Chl a与对照相比上升34%;海胆酮、叶黄素和角黄素受UV-B影响较大,含量增加40%~50%,而β-胡萝卜素和玉米黄质受UV-B影响较小。
藻胆体是蓝藻主要的捕光色素复合物,在UV-B波段有很强的吸收,而且藻胆蛋白在细胞中含量很高,占可溶性蛋白的60%,它们排列在类囊体膜上,在对UV-B敏感的遗传物质周围形成保护。藻胆体吸收的能量通过最外层的藻红蛋白(PE)传递给藻蓝蛋白(PC),藻蓝蛋白(PC)再将能量传递给别藻蓝蛋白(APC),最后通过连接多肽(Lcm)传递给PSⅡ反应中心的Chl a(姜海波等,2004)。Lao和Alexander(1996)研究发现,在UV-B辐射下Anabaena PCC 7120藻胆蛋白发生光降解,藻胆体光降解量子产额Φ295nm在UV-B处理后显著增加;高效液相色谱分析表明,在UV-B处理60min后PC和APC含量下降20%~30%,能量传递效率由于藻胆蛋白降解而明显降低,经17h的UV-B处理后,其能量传递下降60%。Sinha等(1995)发现,Nostoc sp.经UV-B辐射后,藻胆蛋白的吸收光谱显著下降,从而表明藻胆蛋白的迅速降解。低温荧光光谱显示,从藻胆体到PSⅡ反应中心的能量传递受阻,经SDS-PAGE分析进一步证实藻胆蛋白发生降解。
Araoz等发现UV-B引起藻胆蛋白光降解的同时,也诱导藻胆蛋白的重新合成(Araoz&Háder,1997;Araoz et al.,1998b)。细胞中藻胆蛋白的合成和降解存在一种动态平衡,在接受UV-B辐射初期,藻胆蛋白作为一种UV吸收物质,增加合成吸收更多的能量,也可减少UV-B对基因物质的伤害;而随着UV-B剂量的增加,UV-B导致的光降解逐渐明显,最终表现出藻胆蛋白含量的再次下降(姜海波等,2004)。
5.对光合作用的抑制
光合作用过程中的任何一步出现故障必然影响整个过程的进行,因此,UV-B无论损害与光合作用有关的任何分子或结构都会抑制光合作用。
光合作用过程中进行光能吸收、传递、转换的叶绿素及其蛋白质复合物,以及电子传递链上的各组分,都是有秩序地分布在类囊体上,同时偶联因子(CF1)也结合在膜表面。因此,叶绿体片层膜结构状态必然与各种光化学反应的正常进行有密切关系。类囊体受到损伤,必然导致光合放氧和CO2固定速率下降。膜发生改变的同时,膜上的结合酶和蛋白质的活力和状态也必然会发生改变,因为膜脂的流动性与膜结合酶有直接的相关性(陈坤等,2004)。有研究显示,Mg2+-ATPase的活性下降与膜流动性呈正相关。可能是由于膜相变化引起偶联因子(CF1)稳定的构相改变,而使膜上功能位点失活所致。
UV-B辐射对PSⅠ、PSⅡ、Rubisco和ATP酶的损伤不同,PSⅡ的损伤最明显,表明PSⅠ对UV-B不如PSⅡ敏感(Speteac et al.,1996;Vassi et al.,2002)。Rajopopl等(2000)的研究也支持这种观点,他们用1.9 mW/m2的UV-B辐射处理离体的Spirulina platensis类囊体9h,发现PSⅡ活性显著下降,而PSⅠ的活性未受影响。
Campbell等(1998)的研究表明,蓝藻PSⅡ复合体主要由D1、D2蛋白组成,它们连接色素和辅因子,并将电子从水传递到质体醌。在UV-B导致的PSⅡ活性降低过程中,常伴随着D1、D2蛋白的降解。光合作用过程中,D1蛋白和少部分D2蛋白快速周转,它们通过PSⅡ修复循环不断合成新蛋白以取代降解的蛋白。在UV-B胁迫下,这种修复循环平衡被打破,D1蛋白降解速率超过合成速率,D1蛋白出现净损失,从而导致PSⅡ功能下降,光合作用量子产额发生光依赖性下降,即光抑制。光抑制的发生通常是由于捕获的光能超出PSⅡ反应中心的利用能力。研究还发现,在UV-B诱导下D1蛋白的编码基因发生改变,对UV-B具有抗性的D1∶2含量明显增高,这种编码基因转变是蓝藻适应UV-B胁迫的重要保护机制(Campbell et al.,1998;MáTéet al.,1998)。D2蛋白在UV-B辐射下也发生降解,但不如D1蛋白显著(Frisog et al.,1994)。Spetea等(1996)研究发现,UV-B诱导的D1、D2蛋白降解可能存在醌依赖机制,他们用UV-B处理离体的PSⅡ中心复合体发现,当只有QA而无QB时,D1和D2蛋白都发生降解,但D2蛋白的降解不如D1蛋白显著;而在无醌受体的中心复合体中,D1和D2蛋白同步降解。Vassi等(2002)发现,除D1、D2蛋白之外,PSⅡ水氧化系统也明显受UV-B影响,尤其是33kD蛋白,在UV-B辐射下迅速发生降解(Prabha et al.,2002)。
UV-B使光合作用的电子传递受到抑制。研究表明,UV-B辐射增强造成CO2同化能力降低,这与卡尔文循环的关键调节酶Rubisco的含量或活性受抑制有关。Vu等(1983)认为环式磷酸化解偶联作用可能是导致光能转化效率降低的原因。通过荧光检测发现UV-B抑制电子传出PSⅡ,D1、D2受损可能是引起电子传递能力减小的直接原因或与ATP合成酶含量、活性低及细胞色素f受影响有关(陈坤等,2004)。Prabha等(2002)用UV-B处理Synechococcus PCC 7924后发现,其PSⅡ电子传递(H2O→BQ)速率较对照下降48%,在加入外源电子供体后,PSⅡ活性可显著恢复,表明UV-B损伤电子传递主要发生在PSⅡ供体侧。
UV-B导致光合活性降低还可能与Hill反应有关,PSⅡ除向PSⅠ输送电子外,还与放氧系统相连,从水分子中取得电子,Hill反应是这个系统中重要的一环。
6.诱导活性氧的产生
藻类经UV-B照射后,光合色素和氧化还原复合物(如叶绿素、藻胆素和醌类物质等)将聚集的能量传递给氧,导致活性氧的产生。在UV-B的诱导下,藻体还可以通过对光合作用关键酶和呼吸作用的抑制导致ROS的产生,或者电子传递因PSⅡ的D1蛋白降解而受到抑制,使得激发能从三线态叶绿素传递给氧形成单线态氧。ROS自由基包括超氧阴离子(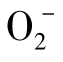 )、羟自由基(OH-)、过氧化氢(H2O2)和单线态氧(1 O2)(姜海波等,2004)。ROS的累积对机体伤害很大,可导致酶失活和细胞内重要分子的崩溃,尤其是1O2和OH·破坏性更强,不仅导致脂质过氧化作用,还能直接攻击DNA造成伤害(Mackerness et al.,1999)。
)、羟自由基(OH-)、过氧化氢(H2O2)和单线态氧(1 O2)(姜海波等,2004)。ROS的累积对机体伤害很大,可导致酶失活和细胞内重要分子的崩溃,尤其是1O2和OH·破坏性更强,不仅导致脂质过氧化作用,还能直接攻击DNA造成伤害(Mackerness et al.,1999)。
He和Háder(2002a,2002b)研究发现,UV-B可直接诱导ROS产生。他们认为ROS产生的两条主要途径是:①通过破坏电子受体或与光合电子传递相关的酶类抑制电子传递,从而诱导ROS生成;②通过光动态反应促进ROS生成,即生色团(叶绿素、藻胆蛋白和醌类物质等)吸收UV-B后通过光敏作用诱导ROS产生。他们在检测Anabaena sp.活体细胞中的ROS生成速率时发现,经UV-A+UV-B+PAR处理的样品产生的ROS明显多于UV-A+PAR或只用PAR处理的样品,说明在UV-B存在的条件下细胞生成ROS的能力更强。
蓝藻类囊体膜脂中含有大量多不饱和脂肪酸残基,在UV-B诱导下极易发生过氧化作用。He&Háder(2002a)研究发现,Anabaena sp.经UV-B+UV-A处理后,MDA含量显著上升,仅用UV-A处理的样品,其MDA含量无显著变化,并且还发现,UV-B和UV-A均导致DNA链断裂,但UV-B的作用更为明显。
7.抑制固氮蓝藻固氮
很多蓝藻具有固氮能力,可以将空气中的游离态氮转化为能被自身和其他生物所利用的化合态氮。UV-B辐射的增强影响蓝藻的固氮能力,导致藻体氮素的缺乏、生长受阻以及产量下降(Dohler et al.,1995;Kumar et al.,1996)。
UV-B对蓝藻固氮的影响,主要反映在对氮代谢相关酶系的作用上。蓝藻细胞经UV-B处理5min,固氮酶就受到抑制,处理30~50min活性完全丧失,固氮酶失活可能与ATP合成酶受抑制有关(Solheim et al.,2002;Tyagi,et al.,2003;Kumar et al.,2003);谷氨酰胺合成酶受UV-B抑制,但不如固氮酶显著;硝酸还原酶不受UV-B抑制,在UV-B处理下其活性还可能受到促进(Donkor&Káder,1991)。
Tyagi等(2003)发现,经UV-B辐射处理的细胞转到白光下,其固氮酶活性可以缓慢恢复,这主要是因为固氮酶的重新合成。Kumar等(2003)发现,Anabaena BT2经2.5W/m2的UV-B照射30min,固氮酶活性完全丧失,90min后细胞全部死亡。在白光恢复实验中,用蛋白质合成抑制剂和PSⅡ的抑制剂处理藻细胞,发现固氮酶的活性恢复实质上是固氮酶的重新合成。
UV-B对蓝藻固氮的影响还受其他因素制约。Tyagi等(2003)研究发现,不同物种对UV-B的敏感性不同,富含PE的蓝藻较富含PC的蓝藻对UV-B的耐受能力更强。Solheim等(2002)还发现,自然条件下生长的蓝藻经UV-B处理3~4d,其固氮潜能降低50%,而在UV-B条件下适应7年的蓝藻,其固氮能力未受影响。Fauchot和Gosselin(2000)认为,浮游植物的垂直混合分布能有效减少UV-B对其氮代谢的影响;L-半胱氨酸、抗坏血酸、还原型谷胱甘肽、L-色氨酸和丙酮酸钠等能阻止UV-B对固氮酶的破坏。Nostocmucorum经2.5W/m2的UVB照射20min,固氮酶完全失活,抗坏血酸和还原型谷胱甘肽的加入则明显延缓酶活性的降低(Tyagi et al.,2003)。
异形胞(Heterocyst)是蓝藻特有的固氮结构,UV-B能抑制其分化。Sinha等(1996)将4种固氮蓝藻置于5W/m2的UV-B辐射下1h,然后在可见光下培养,10d后发现4种蓝藻的异形胞分化均受到抑制,Anabaena sp.和Scytonema sp.的异形胞数量不及对照的50%,Nostoc sp.和Nostoc carmium的异形胞数量较对照下降70%。
8.对脂肪酸的损伤
UV-B导致藻细胞产生的多种自由基攻击类囊体膜中的不饱和脂肪酸,引起不饱和脂肪酸发生氧化,而使膜结构受到破坏,导致物质的泄漏,从而影响光合磷酸化、矿质营养吸收等生理作用(Rail,1995)。
(三)藻类对UV辐射的适应机制
不同物种对UV辐射的敏感性不同,受到的伤害程度也存在差异。说明在进化过程中,不同物种形成了不同的适应UV辐射的机制。从目前的研究来看,藻类对UV辐射的适应机制主要包括以下几种。
1.趋避迁移
在UV辐射增强的环境内,藻类通过向UV辐射较弱的生境迁移来躲避伤害。Castenholz等(1997,2000)认为,UV辐射是引起蓝藻垂直运动的主要原因,蓝藻通过垂直移动的方式躲避高强度UV辐射是其适应UV辐射的一种保护性策略。土壤丝状蓝藻的藻丝体能分化出短而直的可移动的藻殖段迁移到深层土壤。浮游藻类通过重镇物、伪空胞或囊来调节藻体的下沉或漂浮。
2.产生保护色素
大量研究表明,绝大多数藻类本身含有或者经UV辐射诱导后合成光保护色素以屏蔽UV的伤害。这些色素大部分具有很强的UV-B吸收能力,主要有MAAs、Scytonemin和CAR。
MAAs是一类无色、低分子量、具有单一吸收峰的水溶性物质。首先由Shibata(1969)在蓝藻细胞中发现。它们的平均分子量为300Da,最大吸收峰位于310~360nm范围内。其中蓝藻中比较常见的类型主要有紫菀苷-330,Mycosporine-gly,Porphyra-334和Shinorine等。MAAs主要存在于细胞内,在细胞壁外也有少量分布(Castenholz et al.,1997;Sinhar et al.,1998;Cockell&Knowland,1999;Conde etal.,2000)。研究表明,MAAs能截获轰击细胞质靶物质的约30%的光子,是一种重要的保护色素(Castenholz&Garcia-Pichel,2000)。和低浓度或没有MAAs的细胞相比,具有高浓度MAAs的细胞可以抵抗25%以上集中在320nm的紫外线辐射。藻细胞中MAAs含量通常与所接受的UV辐射剂量呈正相关。
MAAs还可作为抗氧化剂,淬灭由于光氧化所产生的自由基和ROS(Conde et al.,2000)。UV-B是诱导藻类合成MAAs的主要因素,而Photosynthetically A-vailable Radiation(PAR)和UV-A对其合成影响不大(Sinha et al.,2002)。UV-B诱导MAAs的合成还受渗透压的影响,在耐盐胁迫的蓝藻中通常含有较高浓度的MAAs,盐胁迫可促进UV-B诱导形成MAAs(Portwich&Garcia-Pichel,1999)。
Scytonemin是一类黄褐色、脂溶性物质。首先由Nägeli(1849)在陆生蓝藻中观察到,随后被命名为“Scytonemin”。通过核磁共振(Nuclear Magnetic Re-sonance,NMR)发现,它们都具有相同的结构(图1-1),从Scytonemin的结构上来看,是一种二聚物,分子式为C36 H20 N2O4。其分子量为544Da,最大吸收峰位于370nm,在252nm、278nm和300nm也有吸收(Proteau et al.,1993;Brenowitz&Castenhol,1997),主要存在于一些蓝藻细胞最外层的胶鞘中或藻席、结皮和群落的顶层中(Ferran&Richard,1991)。
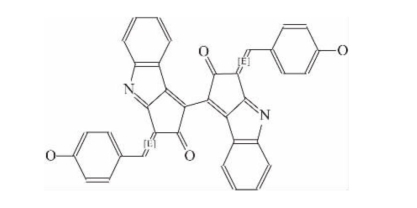
图1-1 Scytonemin的分子结构
Scytonemin能有效屏蔽UV辐射,特别是UV-A的辐射。Brenowitz和Castenhol(1997)研究发现,蓝藻细胞胶鞘中的Scytonemin能吸收90%的UV-A辐射。Scytonemin是一种重要的UV屏蔽色素,在UV辐射下其含量明显增加,且一旦合成就可长期稳定存在(Portwich&Garcia-Pichel,1999)。不同蓝藻的Scytonemin含量不同,有些蓝藻的Scytonemin含量可高达细胞干重的5%(Castenholz,1997)。和MAAs一样,UV-B诱导Scytonemin的合成也受其他环境因素的影响。Dillon等(2002)研究表明,UV-A和渗透压胁迫也能诱导Scytonemin的合成,只是Scytonemin形成的含量有限,不如UV-B明显,但是它们可以明显促进UV-B诱导Scytonemin合成,而其他环境胁迫(如氧胁迫、强光、高温等)不能诱导Scytonemin的形成。但也有不同的报道,Terran和Richard(1991)发现,UV-A能有效地诱导Scytonemin的合成,强光也能促进Scytonemin的合成。
CAR由于能有效地淬灭ROS及能直接吸收过多的光能,从而使光合器官免受UV-B辐射等胁迫的损伤,也被认为是一种光保护色素。在强UV辐射下,CAR含量上升,它与Chl a或藻胆素的比例明显增加(Woodall et al.,1997)。UV-B不仅影响细胞的CAR含量,同时还引起其他组分的改变。经UV-B处理后,细胞中β-胡萝卜素和玉米黄质所占比例升高,且色素组成向玉米黄质转变(Cockell&Knowland,1999)。
3.抗氧化系统和抗氧化物质的产生
氧气对需氧生物的存在是必不可少的,但是氧的某些代谢产物如ROS易于对生物造成细胞伤害。在环境胁迫(如辐射、强光、干旱、高温、重金属、极端温度、空气污染、水胁迫)下,植物体内形成大量的ROS(陈坤等,2004)。所有这些物质都可能与生物分子发生反应或者激起某些生化活动。这种由ROS带来的生物效应称为氧化胁迫。这些ROS的产生对植物组织造成了威胁,因为细胞内的许多成分都对氧化胁迫较敏感(Takeuchi et al.,1996)。
为了抵抗ROS的伤害,细胞进化出一系列酶促进抗氧化防御机制,由抗氧化酶和抗氧化剂完成。前者包括抗坏血酸氧化酶(APx)、谷胱甘肽还原酶(GR)、过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、过氧化物酶(POD)等,后者主要是抗坏血酸(ASA)、谷胱甘肽(GSH)和类胡萝卜素(CAR)等(Tevinim,1981;Foyer,1984;Quaite,1994;Rao etal.,1996),这两类物质可通过氧化还原反应消除UV-B诱导产生的ROS和自由基。一般认为保护酶活性越高,植物抗UV-B损伤的能力也越强。蓝藻之所以在各种胁迫环境下都可以生存,很大程度上得益于这些抗氧化物质的保护,在UV-B下形成的ROS对机体伤害很大,而蓝藻中大量存在的抗氧化物质可有效地清除ROS,因此这些抗氧化系统被认为是蓝藻适应UV-B的又一种保护机制(姜海波等,2004)。
谷胱甘肽和抗坏血酸主要位于基质中(Strid,1982)。谷胱甘肽能还原S-S键,保护酶和结构蛋白的—SH基团,在维持膜结构的完整性、防御膜脂过氧化及清除ROS中起着重要的作用。抗坏血酸是一种关键的可溶性抗氧化剂(Tevinim et al.,1981)。对绿藻的实验表明UV-B辐射增加了两种绿藻细胞内总GSH和GSSG的含量(陈拓等,1999)。在蓝藻中,CAR被认为是一种UV保护色素,不仅因为它可作为UV屏蔽色素吸收UV-B,还因为它可作为抗氧化剂淬灭由光氧化产生的三线态叶绿素和单线态氧等自由基(Woodall et al.,1997;Sandmann et al.,1998)。另外,UV-B辐射还能诱导多胺、脯氨酸等物质的产生(Kramer et al.,1991)。它们主要是通过防止膜的过氧化而保护植物不受UV-B伤害,也被认为是一种抵制UV-B胁迫的抗氧化成分。
4.DNA的修复机制
细胞自身的修复能力与照射剂量有关,即与该剂量所诱导形成的二聚体所占总胸腺嘧啶的总数有关,DNA中二聚体比例越高修复就越困难(Hidege&Vassi,1996)。
DNA一旦发生复制,这些受损的分子可能会引起突变,因此DNA的修复对包括藻类在内的有机体是非常重要的。植物体内DNA损伤的修复机制主要有3种:光修复、切除修复、重组修复,其中依赖光复合酶的光修复是最主要的修复方式。蓝光和UV-B辐射可有效修复UV-B引起的伤害,这是因为它们能激活光复活酶和与切除修复有关的酶类(Britt,1995)。
光修复是一种单酶修复机制,主要识别并修补在UV(310~400nm)和短波可见光(400~480nm)中形成的二聚体。这是原核生物细胞的主要修复方式,在真核有机体中也存在。
切除修复是一种由一系列酶完成的修复机制,包括识别DNA分子的损伤、切除其损坏部分和重新合成。大概过程为:首先由一种对UV专一的内切酶识别出二聚体损坏区,并在其附近,一般是它的末端或几个核苷酸处切出一个裂口,含有二聚体的片断被排出DNA双链。其次,DNA聚合酶Ⅰ就以空出的另一端的单链区为模板,以裂口带有自由基的一端为引链进行修补合成。然后,含有二聚体的小片段被DNA聚合酶的外切酶切除。最后,DNA连接酶把修复的DNA片断和切除了含有二聚体小片段后的DNA片断连接,完成DNA的修复。
重组修复是一个复杂的过程。损伤的DNA在复制时,在相当于母链损伤的部位出现缺口,这些缺口可能被母链上未损坏区所填补。复制后的母链的修复主要是合成DNA的缺口丢掉的核苷酸,此时,DNA聚合酶利用未损坏的DNA链进行修复。
5.提高D1蛋白的周转速度
藻体内一些物质的重新合成也是适应UV辐射的策略。受损蛋白质的增加表达,以及UV耐受型蛋白质的合成,都是蓝藻应对UV辐射的策略。有些蓝藻不含UV屏蔽复合物,却能经受很强的UV辐射,这表明它们具有其他适应和修复机制,例如前述D1蛋白在UV辐射下编码基因发生改变。
藻类通过提高D1蛋白的周转速度来避免UV对PSⅡ的损伤。研究发现,UV-B促进Synechococcus和Synechocytis的psbAⅡ和psbAⅢ的转录,表明它们可以合成新的D1:2蛋白或D1蛋白来促进PSⅡ的修复(Campbell et al.,1998;MáTéet al.,1998)。
6.增加脂肪酸的积累
藻类适应UV辐射的另一种策略是:脂肪酸的大量积累。缪锦来等(2003)研究发现,经UV辐射的南极冰藻藻细胞中脂肪酸的含量显著高于无紫外线辐照培养的藻细胞中脂肪酸总含量。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















