大量研究表明,每一种蛋白质分子的特异生物学功能的实现必须有特异的结构相对应。总体来说,结构的改变也意味着功能的改变或丧失。很多遗传性疾病就是因为某一个关键氨基酸残基的改变导致蛋白质结构的改变或破坏而引起的镰刀型贫血就是一个典型的例子。另外,具有不同功能的蛋白质分子的结构是不同的。功能差异越大,结构的差异也越大。反之,亦然。
(一)与已知结构和功能的蛋白质比较
大量蛋白质的一级结构已被测定或推导出,而很多蛋白的空间结构也已经通过X射线晶体衍射法测定。这些信息都被储存在对世界科学家开放的数据库中。这些信息一个方面帮助我们了解这些被测蛋白的结构和功能关系,同时也为我们研究新发现蛋白之结构和功能提供了重要手段,即将新蛋白的一级和三级结构与数据库中已有的信息进行比较,基于蛋白质结构和功能之间的一一对应关系,如果新蛋白与已知蛋白在结构上存在一定相关性,这就意味着它们之间存在一定的功能相关性。
(二)从存在的保守模体分析蛋白质功能
1.锌指 1985年,英国剑桥大学的Aaron Klug实验室发现每一个蟾蜍卵母细胞转录因子ⅢA(TFA)蛋白分子中含有7~11个锌离子。氨基酸序列分析表明每一个大约30个残基组成的重复序列中都在同样的位置上含有两个Cys和连个His残基。根据这些观察他们提出假设认为每一端重复序列折叠形成一个结构域,其中的两个Cys和两个His残基都与一个共同的锌离子形成配位键。这个结构域画在纸上形同手指,命名为“锌指”。这种被称为Cys2His2类的锌指蛋白都含有1个到几十个如下锌指保守序列:Tyr/Phe-X-Cys-X2-4-Cys-X3-Phe/Tyr-X5-Leu-X2-His-X3-4-His,后来在非DNA结合蛋白中也发现存在这样的锌离子结合序列。第二类“锌指”被称为Cys4类型,因为在这类锌指中与锌离子配位结合的是4个保守的Cys残基。这类锌指的保守序列是:Cys-X2-Cys-X13-Cys-X2-Cys-X14-15-Cys-X5-Cys-X9-Cys-X2-Cys,这里的前面四个Cys和后面的4个Cys结合一个锌离子。还有其他类型的锌指蛋白也被鉴定和发现。
2.亮氨酸拉链 是由α-螺旋形成的超二级结构,是由几组由7个氨基酸残基构成的特定序列,通过彼此相互作用而形成的。这种7个氨基酸构成的序列有特征的模体,常被称为七元重复单位(hepad repeat)。以酵母转录因子GCN4的亮氨酸拉链区为例,这一肽段由33个氨基酸组成,其序列如表8-4所示,显示如下特征:处于中间d位的氨基酸残基均是亮氨酸;a位的是疏水性氨基酸残基;e位和g位上的氨基酸残基多数是可以形成盐键的酸性氨基酸残基或碱性氨基酸残基。这样的序列之间既有d位的亮氨酸和a位的疏水性氨基酸残基间的疏水相互作用,又有e位和g位带电的氨基酸残基间的盐键,见图8-8。如果两段肽链中同时存在若干个七元重复单位,借助特定模体间的相互作用,形成稳定的结构。具有几个这样重复结构肽段组成的超二级结构称为亮氨酸拉链。两段肽链中七元重复单位越多,它们的相互作用越强。同一条多肽链或不同多肽链肽段之间都会出现这种重复单位,以亮氨酸拉链为基础的超二级结构也被称为卷曲的螺旋,而且不同类型的蛋白质分子中这种超二级结构非常普遍(图8-9)。
表8-4 GCN4中亮氨酸拉链区的氨基酸残基序列的七元重复单位
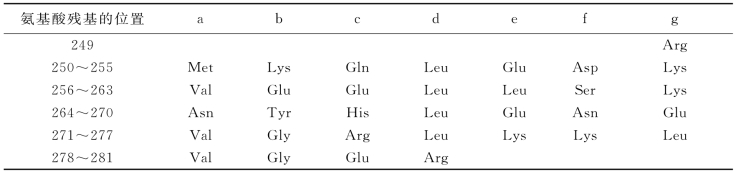
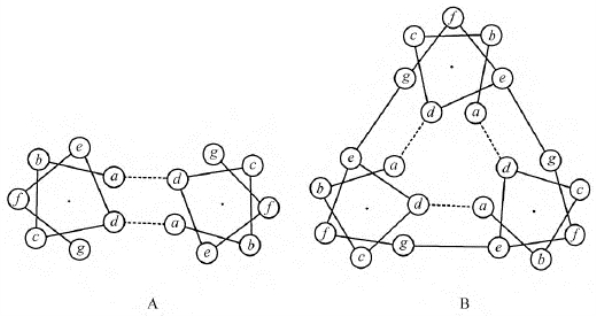
图8-8 两股和三股肽链形成的卷曲螺旋中螺旋轮及一些氨基酸残基间的相互作用
A.二股卷曲螺旋;B.三股卷曲螺旋
3.EF手 有些蛋白质以α螺旋这种二级结构为主(一般的标准为α螺旋的含量大于15%,β折叠的含量小于10%),甚至只含有α螺旋,其螺旋的排列方式不同,如钙结合蛋白,该蛋白含有6段α螺旋,其中CD和EF4段螺旋分别为2段环形的小肽连接起来,构成了螺旋-环-螺旋的超二级结构。两个钙离子结合在环区,环区两侧的螺旋间的相对取向类似于人手伸展且相互垂直的拇指和示指,这样的超二级结构被称为EF手(图8-10)。锌指结构和EF手结构的命名与tRNA三叶草结构一样,都在随后的研究中证实并非与手指或三叶草形状一样,但后人还是沿用了当时的说法。
4.发夹结构 与以α螺旋这种二级结构为主的蛋白质一样,有些蛋白质结构含有较多的β折叠结构,一般β折叠大于15%,α螺旋小于10%,因为单股β折叠链,一些肽键中的NH—和C O都没有形成双键,仍处于不稳定状态,因此这些蛋白质分子结构中常由彼此间通过氢键形成β片层结构的倾向,绝大多数β折叠链的相对走向都是反平行的。在这类蛋白质中,最简单的是发夹结构。图8-11A所示为已被广泛研究的蛋白质——牛胰蛋白酶抑制药,由58个氨基酸组成,含有3对二巯键,分子中最特出的特点就是有一个很大的发夹结构,此外还有一股短的β折叠链和2段小的螺旋。图8-11B则是以2个发夹为主体的蛋白质,是一种从半环扁尾蛇的蛇毒中分离得到的神经毒蛋白。它由62个氨基酸组成,只有β片层和β转角,不含α螺旋,它的5股β折叠链中的4股形成2对发夹。
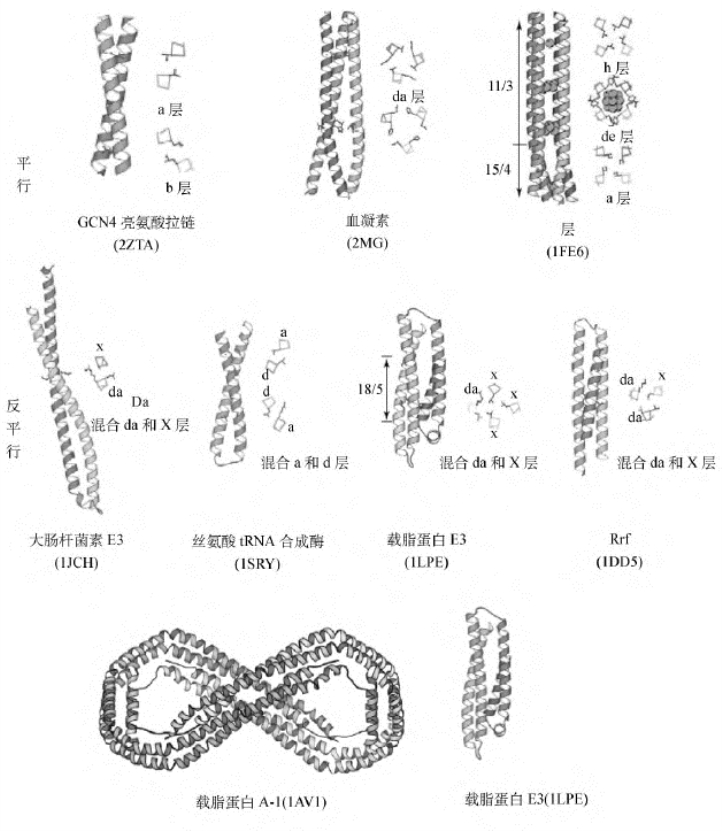
图8-9 一些复杂的卷曲螺旋
5.核苷酸结合模体 α螺旋和β折叠都出现在蛋白质分子结构中,交替出现且各自的含量都大于15%,这类蛋白质绝大多数是能与核苷酸及其衍生物(如辅酶NAD或NADP)结合的蛋白质,还有各种类型的一糖类为底物的酶(如参与糖酵解的一系列酶)。它们结构特征是出现核苷酸结合模体,即由βαβ′组成的超二级结构(Rossmann折叠),这种结构单位从氨基酸序列水平很难看出什么明显的相似性(即同源性),但在构象水平和结合核苷酸或核苷酸单位的性质方面表现明显的相似性:核苷酸、酶等总是结合在由两个β链的C端和α螺旋的N端,即α螺旋的总体双极性的正电极与核苷酸的磷酸单位邻近(图8-12)。
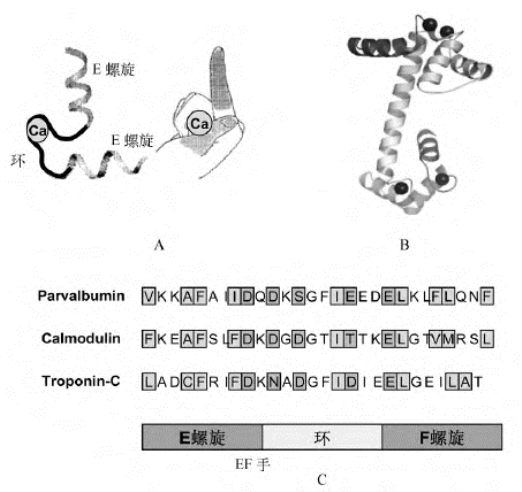
图8-10 超二级结构——EF手
A.钙结合结构单元;B.一种来自于鸡的钙调蛋白的三维晶体结构,钙调蛋白是真核生物中一类高度保守蛋白家族,它在钙依赖性的信号传导途径中发挥重要作用;C.3种不同蛋白质中结合EF模块的氨基酸序列,黄色代表钙结合残基,绿色代表形成模块疏水核心的残基
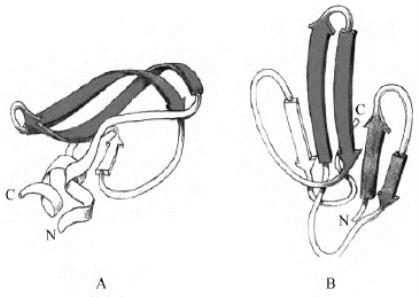
图8-11 以发夹为主体的全β蛋白
A.牛胰脏中的胰蛋白酶抑制药;B.半环扁尾蛇毒神经毒蛋白
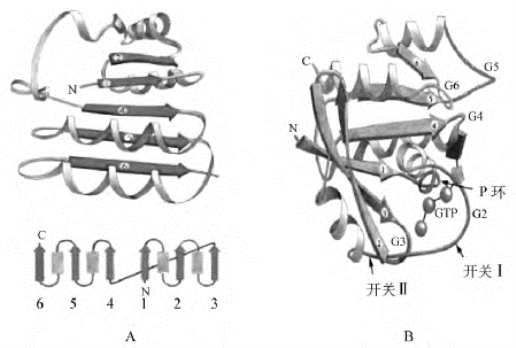
图8-12 含有Rossmann折叠模式的α/β类蛋白质/结构域
A.NAD结合域(βαβ′);B.ATP或GTP结合域
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。
















