基因表达的基本内容是RNA合成与加工和蛋白质合成与加工,这些反应是通过蛋白质与核酸的相互作用而精确进行的,如RNA聚合酶和转录因子、延长因子与DNA的相互作用,核糖体和翻译起始因子、终止因子与mRNA的相互作用等。所谓基因表达调控,实际上就是调节和控制上述蛋白质与核酸相互作用的过程。调控的分子机制实际上是蛋白质与蛋白质之间、蛋白质与核酸之间的相互作用。因此,了解与调控相关的核酸和蛋白质的结构特点及相互作用的特点有助于了解基因表达调控的基本机制。
在基因内和基因外都有一些特定的DNA序列,与结构基因表达调控相关、能够被基因调控蛋白特异性识别和结合,这些特定的DNA序列称为顺式作用元件(cis-acting elements),亦称为顺式调控元件。简单来说,顺式作用元件就是指影响同一分子内基因表达活性的DNA序列。在原核生物中主要包括启动子、阻遏蛋白结合位点、正调控蛋白结合位点、增强子等。
另外,在原核生物和真核生物细胞中,还存在有一些能够与顺式作用元件特异性结合、并对基因表达的转录起始过程有调控作用的蛋白质,称为基因特异性转录因子(gene specific transcription factors),在原核生物中,对基因表达有激活作用的蛋白质称为激活蛋白或正调控蛋白,对基因表达有抑制作用的蛋白质称为阻遏蛋白。
(一)启动子的结构特点及其功能
启动子(promoter)是RNA聚合酶特异性识别、结合和启动转录的一段DNA序列,启动子具有方向性,位于转录起始点上游,本身并不被转录。每一个基因都具有启动子,个个基因的启动子序列具有较高的同源性,但并不一定完全一样。
1.启动子决定转录方向及模板链 一个基因中DNA双链的碱基对的顺序数,是按照含有RNA序列信息的DNA链,即编码链的上、下游方向确定的。DNA链中与RNA链5′端的第一个核苷酸对应的碱基标记为+1(图4-12),由此碱基向上游(向左)的碱基顺序数为负(-1,-2,…),向下游(向右)的碱基顺序数为正(+2,+3,…)。
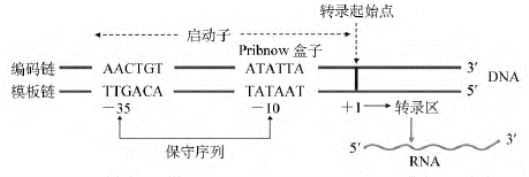
图4-12 原核基因启动子的结构
E.coli的启动子区长40~60bp,至少包括3个功能区。一是起始部位(initiation site),即+1区;二是结合部位(binding site),位于-10区,为RNA聚合酶与启动子牢固结合的位点,该区有一最保守的六连体,其共有序列为TATAAT,因其是1975年由Pribnow首先发现,故又称Pribnow盒(Pribnow box);三是识别部位(recognition site),位于-35区,该区共有序列为TTGACA。许多实验证实,-35区是RNA聚合酶对转录起始的辨认位点。基因转录时,σ因子识别并结合-35区和-10区,全酶结合DNA后覆盖的区域是-40~+20,RNA聚合酶的移动方向是沿着模板链的3′→5′,即启动子决定着转录的方向。如果启动子倒转了方向(见后面的倒位蛋白调控),RNA聚合酶的移动也随之倒转,原来转录的结构基因就不再被转录。
2.启动子决定转录效率 各种原核基因启动子特殊区域内,在转录起始点上游-10及-35区常存在一些相似序列,称为一致序列(consensus sequences)。通过比较大量的E.coli启动子,表明这两个序列中各碱基的出现频率为:-35:T82G78A65C54A95;-10:T80A95T45A60 A50T96(下角标数字表示核苷酸在所有启动子中出现的频率)。显然,如果一个基因的启动子序列与一致序列越相近,则该启动子的效率就越高,即属于所谓的强启动子;相反,如果一个基因的启动子序列与上面的一致序列相差越大,则该启动子的效率就越低,即属于所谓的弱启动子。不同基因在启动子序列上的差异实际也构成了调节基因表达的一种手段。
RNA聚合酶与启动子结合及启动转录的效率在很大程度上取决于-10区和-35区的一致序列及其间隔距离以及它们与转录起始点的距离。若以上两个一致序列的关键碱基发生突变,可使RNA聚合酶识别、结合启动子的能力和启动转录效率下降几个数量级。突变实验发现:-35区一致序列的突变会降低RNA聚合酶与启动子识别、结合的能力,但不影响转录起始点附近DNA双链的解链;而-10区一致序列的突变不影响RNA聚合酶与启动子识别、结合的能力,但可降低转录起始点附近DNA双链的解链速度。识别E.coli启动子中一致序列的σ因子主要是σ70亚单位。启动子序列与上述序列越接近,σ70与之结合的能力越强。
(二)调控蛋白的结构特点
多肽链对特异DNA序列的识别与结合可通过各种特定结构进行。通过DNA-蛋白质相互作用分析,现已鉴定出多种结合特异DNA序列的蛋白质结构元件,其中最常见者有广泛存在于原核、真核调节蛋白中的螺旋-转角-螺旋(helix-turn-helix,HTH)和锌指结构(zinc finger,锌指结构中的两个Cys,两个His,或4个都是Cys以配位键与Zn2+相互作用)。这些结构是蛋白质与DNA序列特异结合的结构基元(模体),通常是与DNA大沟接触。但也有例外,例如大肠埃希菌的整合宿主因子通过其结构中所含的反平行β伸展选择性地与DNA小沟相互作用,细菌组蛋白样蛋白通过环状β折叠结构与DNA小沟结合。
在lac阻遏蛋白、CAP、trp阻遏蛋白、λ阻遏蛋白等基因转录调控蛋白中,都有一个类似的结构模体(structural motif),即HTH结构。不同蛋白因子的HTH结构并不完全一样,但与各自的靶位点的结合都如同锁与钥匙一样匹配。
(三)操纵序列和阻遏蛋白
1.操纵序列(operator) 亦称为操纵基因(实际上并不是一个基因),是阻遏蛋白识别与结合的一小段DNA序列,操纵序列紧接在启动子下游,与启动子交错重叠。
2.阻遏蛋白 是一类在转录水平对基因表达产生负调控作用的蛋白质,它可以识别、结合操纵序列,抑制开放启动子复合物的形成,从而抑制基因转录,介导负性调节。当阻遏蛋白与DNA结合后,RNA聚合酶虽然仍然可以与启动子结合,但不能形成开放的启动子复合物,不能启动转录,这种作用称为阻遏(repression);相反,当特定的信号分子与阻遏蛋白结合,使阻遏蛋白变构失活,与DNA解聚,称为去阻遏,或脱阻遏(derepression)。
阻遏蛋白都可以与信号分子结合而发生变构,在不同构象时,阻遏蛋白或者与DNA结合,或者与DNA解离。在可诱导型操纵子中,信号分子使阻遏物从DNA释放下来,解除对转录的抑制作用;在可阻遏型操纵子中,信号分子使阻遏物结合DNA,抑制转录。在两种情况下,阻遏蛋白结合于DNA后都是抑制转录,这种类型的基因表达调控称为负调控。
(1)可诱导型操纵子:E.coli的乳糖操纵子(lac operon)是一种典型的可诱导型操纵子,之所以说是诱导型操纵子是因为乳糖作为诱导物来诱导其操纵子发生转录。乳糖操纵子含Z、Y及A三个结构基因,分别编码β-半乳糖苷酶(β-galactosidase)、半乳糖苷透酶(β-galactoside permease,也称乳糖透酶)和半乳糖苷乙酰化酶(galactoside acetylase),此外还有操纵序列O、启动序列P及调节基因I。I基因编码产生阻遏蛋白,阻遏蛋白是由相同亚基构成的四聚体。在没有乳糖的条件下,阻遏蛋白能与操纵序列结合,操纵序列为回文序列,位于-7至+28区,与启动子有部分重叠。阻遏蛋白与操纵序列结合后,抑制结构基因的转录;当有乳糖存在时,lac操纵子即可被诱导开放,但实际上真正的诱导剂并不是乳糖本身,而是由乳糖代谢产生的别乳糖与阻遏蛋白结合,使阻遏蛋白的构象发生改变,变构后的阻遏蛋白不能与操纵序列结合,不能阻止开放的启动子复合物的形成,RNA聚合酶开始转录结构基因(图4-13)。
异丙基硫代半乳糖苷(isopropylthiogalactoside,IPTG)是一种人工合成的乳糖类似物,能够迅速和持续地刺激乳糖操纵子结构基因的表达,它本身并不能被降解,因此,被称为安慰诱导剂。在基因工程中,β-半乳糖苷酶的一种人工显色底物5-溴-4-氯-3-吲哚-β-D-半乳糖苷(5-bromo-4-chloro-3-indolyl-β-D-galactoside,Xgal)与IPTG的配合使用常用来筛选重组体。
(2)可阻遏操纵子:E.coli中色氨酸操纵子(trpoperon)是一种典型的可阻遏型操纵子,色氨酸作为辅阻遏物与阻遏蛋白结合而阻止色氨酸操纵子的表达。色氨酸操纵子的结构基因包括编码5种酶的基因E、D、C、B、A,参与色氨酸的合成代谢,另外,在trp E的上游含有一段前导序列(trp L),编码一段寡肽,其内部含有弱化子序列。调控元件有启动子和操纵序列。色氨酸操纵子表达的调控有两种方式,一种通过阻遏蛋白的调控;另一种是通过衰减子作用(attenuation),此处介绍阻遏蛋白的作用。
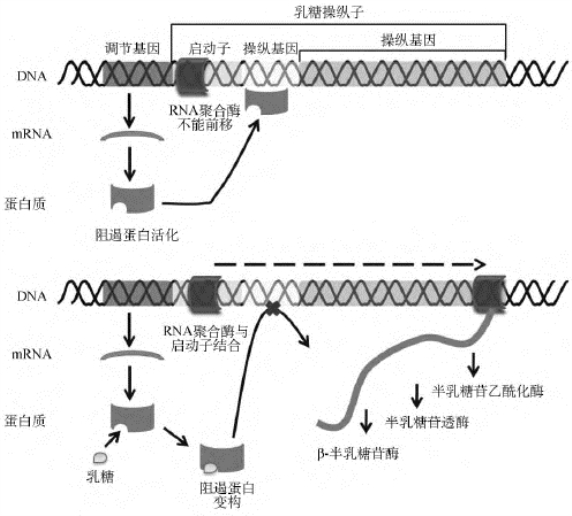
图4-13 大肠埃希菌乳糖操纵子阻遏蛋白的作用
色氨酸操纵子阻遏物是由色氨酸操纵子上游R基因所表达的产物,相对分子质量为78ku,称Trp阻遏蛋白(Trp repressor protein R,TrpR),为二聚体蛋白质。单独的TrpR并不能与色氨酸操纵序列结合,因此,如果细胞内的色氨酸浓度很低,TrpR无活性,色氨酸操纵子就处于开放状态,参与色氨酸合成的酶就会表达,为细胞合成必需的色氨酸。当细胞内的色氨酸累积到一定水平后,色氨酸作为辅阻遏物与TrpR结合,诱导其构象变化使之激活,随后,TrpR-Trp与操纵序列结合,阻遏结构基因的转录(图4-14)。
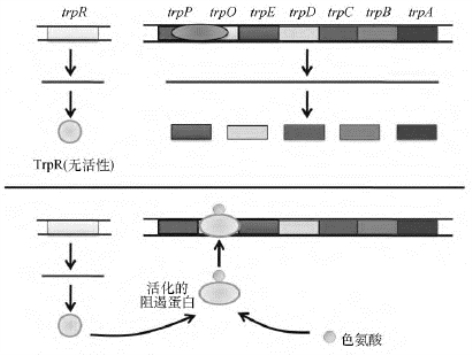
图4-14 色氨酸操纵子阻遏蛋白的作用
(四)正调控蛋白结合位点及激活蛋白
与负调控相反,一些调控蛋白结合于特异DNA序列后可促进基因的转录,这种基因表达调控的方式称为正调控。E.coli中的一些弱启动子,本身结合RNA聚合酶的作用很弱,对于这些启动子来说,正调控作用是十分重要的。转录的激活是通过一种激活蛋白结合于邻近的特异DNA序列,提高RNA聚合酶与启动序列的结合能力,促进转录的启动。
E.coli的分解代谢物基因激活蛋白(catabolite gene activator protein,CAP)是一种研究得较多的激活蛋白,这种蛋白可将葡萄糖饥饿信号传递给许多操纵子,使细菌在缺乏葡萄糖的环境中可以利用其他碳源。CAP由2个相同的亚基组成,每个亚基含有209个氨基酸残基,有2个结构域,1个在N端,含有结合cAMP的位点,另一个在C端,含有螺旋-转角-螺旋结构,负责与DNA结合。CAP本身的活性是由cAMP激活的,当cAMP结合于CAP后,诱导CAP发生构象改变,致使其C端的螺旋-转角-螺旋采取合适的取向,从而能够识别DNA上的结合位点,激活邻近基因的转录。当cAMP水平降低时,cAMP与CAP解离,CAP转回到无活性的构象,并与DNA解离,这将关闭葡萄糖以外的其他与糖代谢相关的操纵子。由于CAP的作用依赖于cAMP,因此,也有人将CAP称为cAMP受体蛋白(cAMP receptor protrin,CRP)。
使用DNA酶Ⅰ-足印法得到了CAP-cAMP与DNA结合的特异性位点,由26bp组成,位于乳糖操纵子的启动子紧靠-35区域的上游,其一致序列是一段不完善的回文序列——TGTGA-N6-TCACA,该位点被称为CAP位点。CAP-cAMP与CAP位点的结合可导致周围的DNA产生小的弯曲,致使自身能够与RNA聚合酶全酶的α亚基的羧基端相互作用,从而有利于RNA聚合酶与启动子的结合以及DNA双螺旋的局部解链,最终促进了下游基因的转录(图4-15)。
(五)增强子与激活蛋白
细菌中也存在可称为增强子的DNA元件,特定的蛋白质可与这种元件结合并激活基因转录,而这些元件的位置并不影响其功能。
谷氨酰胺合成酶基因(glnA)启动子是由含有σ54的RNA聚合酶全酶所识别,σ54全酶可以稳定地结合glnA的启动子,但是不能打开转录起始部位的DNA双链、形成开放的起始复合物,所形成的只是“闭合起始复合物”(closed complex),不能转录。在启动子的上游一百多bp处,有两个ntrC蛋白结合位点(增强子),正向影响谷氨酰胺基因的表达。ntrC蛋白是大肠埃希菌氮代谢基因的激活蛋白,通过磷酸化和去磷酸化调节自身活性。非磷酸化的ntrC蛋白也可以与DNA上的ntrC蛋白结合位点结合,但对转录没有调控作用。当磷酸化的ntrC结合于上述位点,或结合在位点上的ntrC蛋白被磷酸化,即可发挥调控功能,启动转录。ntrC蛋白有一个ATP酶活性结构域,通过水解ATP提供能量,提高RNA聚合酶解开DNA螺旋的能力,形成“开放起始复合物”(open complex),然后开始转录(图4-16)。
ntrC蛋白的调控活性由ntrB蛋白控制。ntrB蛋白既具有激酶活性,使ntrC磷酸化,又具有磷酸酶活性,使ntrC蛋白去磷酸化。ntrB中有一个调节亚基,称为PⅡ蛋白,两者结合时,ntrB以磷酸酶活性为主;两者解离时,ntrB蛋白则以激酶活性为主。当谷氨酰胺缺乏时,细胞内α-酮戊二酸/谷氨酰胺的比值增高,可使尿苷酸化酶(uridylating enzyme)激活。该酶催化UMP与PⅡ蛋白结合,PⅡ蛋白随之与ntrB解离,使ntrB的激酶活性增高,将ntrC磷酸化。但PⅡ如何去掉UMP,调节ntrC去磷酸化,目前尚不清楚。
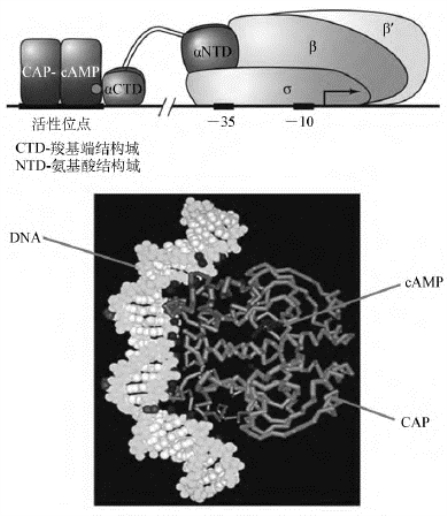
图4-15 CAP-cAMP与RNA聚合酶以及乳糖操纵子的相互作用
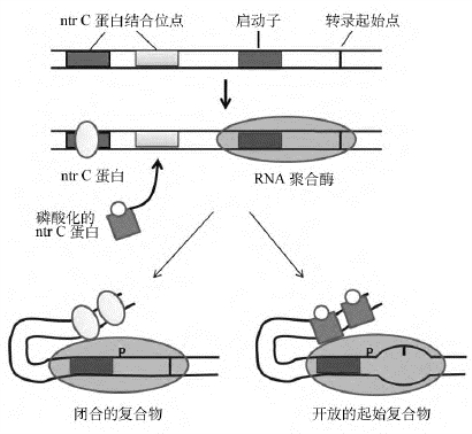
图4-16 ntrC蛋白对转录的正调控作用
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。













