首先观察并描述钙细胞生物学功能的人是英国生理学家Ringer。1883年,他在做离体蛙心肌收缩实验时发现,用蒸馏水代替自来水配制溶液后,肌肉组织丧失了收缩功能。后来证实,这是由于蒸馏水中缺乏Ca2+的原因,说明蛙心收缩依赖于细胞外Ca2+的存在。50年后,Locke发现,去除Ca2+可以组织蛙缝匠肌神经肌肉接头处神经冲动的传导。1943年,Kamada和Kinoshita发现,将Ca2+直接加入肌肉纤维,可使肌肉产生收缩,而其他离子如Na+、K+、Mg2+等没有这样的作用。但对Ca2+深入的认识是在钙调蛋白发现以后,在此基础上,大量实验证实,Ca2+是细胞内的第二信使。
细胞内钙以结合型和游离型两种形式存在。其中99.9%以上为结合钙,主要分布在细胞核、线粒体、内质网/肌浆网和细胞膜。游离Ca2+的分布和转移是形成Ca2+信号的基础。这种分布和转移形成了胞质与细胞内钙库或细胞外液Ca2+之间的浓度梯度,胞质中Ca2+浓度在10-8~10-6 mol/L,而细胞外液中Ca2+浓度约10-3 mol/L。当某种刺激引起胞质Ca2+浓度大幅度增加,并与一些酶或蛋白质结合,使其激活,引起生理反应。能够引起胞质Ca2+浓度增加的原因有两个:一是细胞膜上钙离子通道开放,引起钙内流;另一个是细胞内钙库膜上的钙离子通道开放,引起钙释放。除肌肉收缩外,钙调蛋白(calmodulin,CaM)可看做是胞质中Ca2+的受体。
(一)PLC-IP3/DAG-PKC信号转导通路
肌醇脂质广泛存在于各种动植物细胞中,是肌醇磷脂和磷酸肌醇的总称。肌醇磷脂由甘油、硬脂酸、花生四烯酸和肌醇构成,包括磷脂酰肌醇(phosphatidylinositol,PI)和多磷脂酰肌醇(poly phosphatidylinositol,PPI)。PPI是PI的肌醇环第4、5位上羟基在激酶的作用下与多分子磷酸缩合形成的。如磷脂酰肌醇-4-磷酸(phosphatidylinositol-4-phosphate,PIP)、磷脂酰肌醇-4,5-二磷酸(phosphatidylinositol-4,5-bisphosphate,PIP2)。磷酸肌醇是磷酸与肌醇羟基缩合而成的脂类。目前已知的有20余种,与细胞功能密切相关的有:1-磷酸肌醇(IP1)、1,4-二磷酸肌醇(IP2)、1,4,5-三磷酸肌醇(IP3)、3,4,5,6-四磷酸肌醇(IP4)等。
1955年,Hokin等将乙酰胆碱作用于鸽的胰腺和鼠的大脑时观察到,某种激素或生物活性物质作用于靶细胞时,放射性磷酸能迅速进入生物膜磷脂,尤其是进入磷脂酰肌醇中。由此,对肌醇磷脂的研究逐渐发展起来。
20世纪80年代,大量研究证明肌醇磷脂的降解是跨膜信号转导过程的重要步骤,并将肌醇脂质代谢中产生的二酯酰甘油(diacylglycerol,DAG),三磷酸肌醇(inositol triphosphate,IP3)确认为第二信使。以DAG和IP3为第二信使的双信号途径既可以单独调节细胞内的反应,又可与AC-cAMP-PKA信号转导通路及酪氨酸蛋白激酶系统相偶联,组成信号转导网络系统,共同调节细胞代谢和基因表达。
1.DAG和IP3的生物合成和主要功能
(1)生物合成:催化DAG和IP3生成的酶是磷脂酰肌醇特异性磷脂酶C(phospholipase C,PLC)。PLC有3个家族:PLC-β、PLC-γ和PLC-δ。其中PLC-γ又包括PLC-γ1和PLC-γ2,其中PLC-γ1是磷脂酰肌醇特异性磷酸二酯酶。当乙酰胆碱、组胺、肾上腺素、ATP、谷氨酸、促甲状腺素释放激素和ADH等作用于靶细胞膜上特异性受体后,可使特定的G蛋白(Gq)激活PLC-β。此外,当相应膜受体被激活后,PLC-γ1的酪氨酸残基被磷酸化而激活,继而特异性水解膜组分PIP2生成DAG和IP3(图12-7)。
(2)主要功能:IP3为水溶性,生成后从细胞膜扩散至胞质中与内质网和肌浆网上的受体结合。其受体由4个相对分子量为260ku的糖蛋白亚基组成,是IP3控制的Ca2+通道。在结合IP3后,受体构象改变,离子通道打开,促进钙库内Ca2+释放,胞质Ca2+浓度迅速升高,产生各种生物学效应。DAG生成后仍留在细胞膜上,在磷脂酰丝氨酸和Ca2+的配合下激活蛋白激酶C(protein kinase,PKC)(图12-8)。静止细胞中的PKC主要存在于胞质中,当细胞受到刺激后,PKC从胞质转移到细胞膜上,此过程称为转位(translocation),转位是PKC被激活的标志。PKC的活性依赖于Ca2+和磷脂的存在。由于DAG能增加PKC对底物的亲和力,故只有在DAG存在的前提下,生理浓度的Ca2+才能起作用。
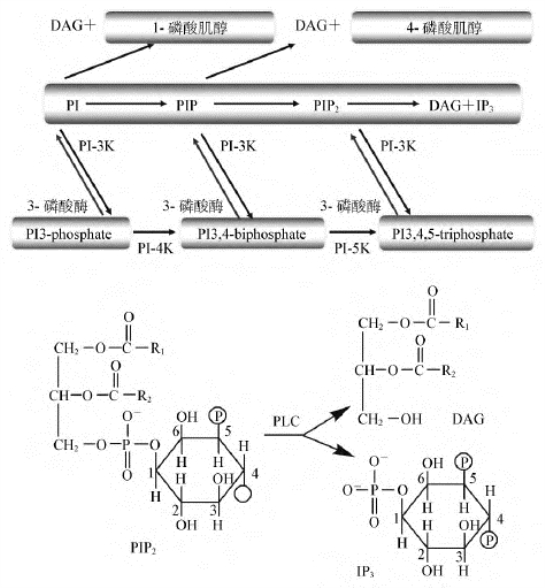
图12-7 脂类第二信使的生成
2.PKC的结构和主要功能 PKC是Nishizuka等于1977年在鼠脑中发现的一类非常重要的信号转导分子,在细胞的生长分化的调控中及其他多种细胞功能上具有关键性的调节作用。它能催化底物蛋白分子内丝氨酸/苏氨酸残基发生磷酸化,是磷脂酰肌醇的衍生物如DAG、IP3及Ca2+等信息物质的重要靶分子。
(1)结构:目前至少发现12种PKC同工酶,广泛存在于各种组织细胞中,如PKCα、PKCβⅠ、PKCβⅡ、PKCγ、PKCδ、PKCε、PKCζ、PKCη、PKCθ、PKCι、PKCμ和PKCν等,参与多种的信号转导通路(图12-9)。
各种PKC均为一条多肽链组成,分子量77~90ku。在蛋白酶的作用下可水解为两部分,一个是具有完全活性的,约50ku的激酶结构域;另一个是30ku的调节结构域,可与激动剂、DAG、Ca2+和磷脂等结合。PKC的氨基酸序列可分为4个保守的功能区(C1~C4)和5个可变区(V1~V5)(图12-10)。
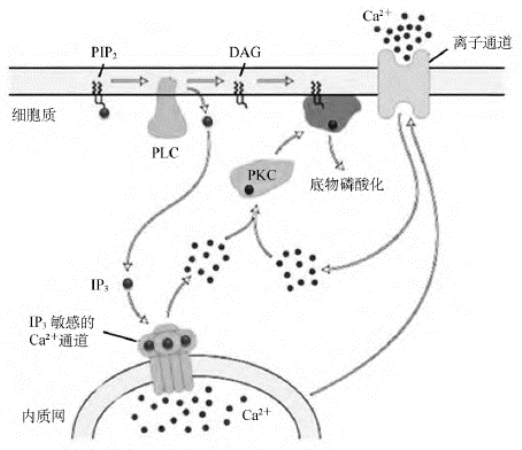
图12-8 IP3和DAG的作用
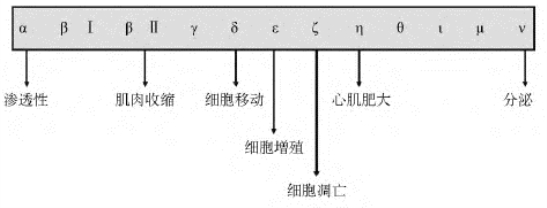
图12-9 PKC信号转导通路的多样性
(2)主要功能:氨基端的调节结构域和羧基端的催化结构域通过一个可被蛋白酶水解的“铰链区”连接,该区域在酶的激活过程中易变,从而使PKC活性部位暴露。C1区是膜结合区,形成锌指结构,是PKC激活剂DAG和佛波酯的结合位点。C2区是Ca2+敏感区是Ca2+/磷脂结合位点,可能介导了蛋白质-蛋白质间的相互作用。C3和C4区分别含有ATP和底物的结合位点。在激酶结构域中有激活环、翻转模体和疏水模体3个保守的磷酸化模体,是磷酸化调节的开关,控制着PKC分子内和分子间的相互作用。这3个模体的自身磷酸化修饰是PKC能否使底物磷酸化的先决条件。细胞信号转导过程中的多条途径都可以激活PKC,最终影响机体的代谢、基因表达、细胞分化和增殖等。
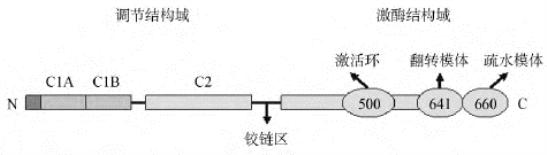
图12-10 PKC结构域
PKC被激活后可通过磷酸化多种膜受体、膜蛋白和酶的丝氨酸/苏氨酸残基来改变功能蛋白的活性和性质,影响细胞内信息传递,从而启动一系列生理、生化反应。如PKC可通过磷酸化细胞膜的Ca2+通道,促进Ca2+内流,提高胞质Ca2+浓度,调节多种生理活动。此外,PKC还能磷酸化钙库的Ca2+-ATP酶,使Ca2+进入钙库,防止钙库耗竭。一些代谢关键酶,如糖原合酶、丙酮酸激酶、丙酮酸羧化酶等都受Ca2+和磷酸化共同调节。
PKC另一个重要的作用是调节基因表达。它对基因的活化可分为早期反应和晚期反应两个阶段(图12-11)。PKC能通过磷酸化立早基因(如c-fos、AP/c-jun)的反式作用因子来加速其表达。立早基因表达的蛋白质具有第三信使的功能,这些蛋白质在受到磷酸化修饰后,最终活化晚期反应基因并导致细胞增生和(或)核型变化。促癌剂——佛波酯(phorbol ester)正是作为PKC的强激活剂而引起细胞持续增生,诱导癌变。
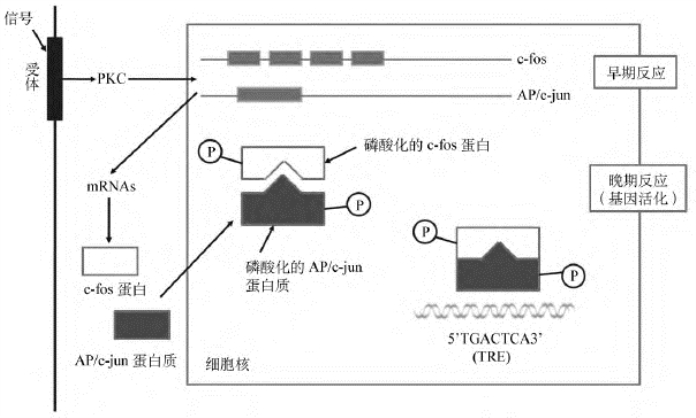
图12-11 PKC对基因的活化作用
IP3信号的终止是通过去磷酸化形成IP2,或被磷酸化形成IP4。Ca2+由质膜上的Ca2+泵和Na+-Ca2+交换器将抽出细胞,或由内质网膜上的钙泵抽进内质网。
DAG通过两种途径终止其信使作用:一是被DAG-激酶磷酸化成为磷脂酸,进入磷脂酰肌醇循环;二是被DAG酯酶水解成单酯酰甘油。由于DAG代谢周期很短,不可能长期维持PKC活性,而细胞增殖或分化行为的变化又要求PKC长期活性所产生的效应。现发现另一种DAG生成途径,即由磷脂酶催化质膜上的磷脂酰胆碱断裂产生的DAG,用来维持PKC的长期效应。
血管紧张素Ⅱ受体属于G蛋白偶联受体,偶联的G蛋白是Gq,通过PLC-IP3/DAG-PKC信号转导通路发挥作用(图12-12)。此外,乙酰胆碱、5-HT、促甲状腺激素释放激素、组胺、促性腺激素释放激素等都通过此途径产生生物学效应。
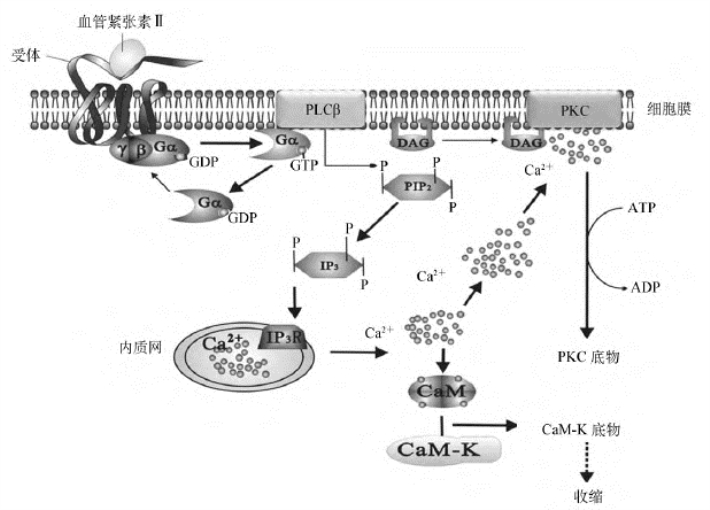
图12-12 血管紧张素Ⅱ受体通过PLC-IP3/DAG-PKC信号转导通路发挥作用
(二)Ca2+-钙调蛋白依赖性蛋白激酶途径
CaM也称为钙结合蛋白,由一条由148个多肽链组成,分子量约16.67ku,是细胞内重要的调节蛋白。
1.结构 在CaM上有4个氨基酸序列相似的结构域,每端2个,每个能结合1个Ca2+(图12-13)。每个结构域均由30个氨基酸残基构成1个螺旋-环-螺旋的结构,通常被称为EF。这种结构在空间上成对排列,每个螺旋结构形成1个扭转的四螺旋,以增加与Ca2+的亲和力。
2.主要功能
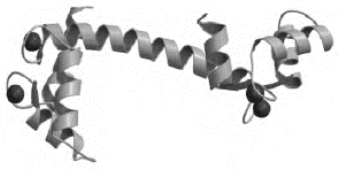
图12-13 钙调蛋白结构域
(1)Ca2+/CaM复合物的功能:CaM本身无催化活性,在未与Ca2+结合之前,其中心螺旋被末端结构所掩盖,不能与蛋白结合。当胞质的Ca2+浓度达到10-5 mol/L时,CaM与4个Ca2+结合,形成Ca2+/CaM复合物,暴露末端疏水基团和中心α-螺旋,并形成铰链状,围绕在靶蛋白周围。Ca2+/CaM复合物的功能主要包括:①开放肌浆网和细胞膜上的Ca2+通道,引起Ca2+内流;②激活Ca2+/CaM依赖的AC和CaM依赖的GC,使cAMP和cGMP浓度增加;③激活Ca2+/CaM依赖的PDE,使环核苷酸降解;④激活Ca2+/CaM依赖的蛋白激酶、Ca2+/CaM依赖的磷酸化酶激酶、Ca2+/CaM依赖的磷酸酶等,通过磷酸化靶蛋白的丝氨酸和(或)苏氨酸残基,调节蛋白活性;⑤激活CaM依赖的肌醇-3-激酶,使IP3转变为1,3,4,5-四磷酸肌醇,关闭磷酸肌醇信号转导途径。
(2)Ca2+/CaM依赖的蛋白激酶的功能:Ca2+/CaM依赖的蛋白激酶(Ca2+/calmodulin dependent protein kinase,CaMK)是一组能与Ca2+/CaM结合并被激活的蛋白激酶,主要包括CaM激酶Ⅰ(CaMKⅠ)、CaM激酶Ⅱ(CaMKⅡ)、CaM激酶Ⅳ(CaMKⅣ)和CaM激酶的激酶(CaMKK)。细胞对Ca2+的反应取决于细胞内CaMK的种类,如在哺乳类脑神经元突触处CaMKⅡ十分丰富,与记忆形成有关。该蛋白发生点突变的小鼠表现出明显的记忆无能。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















