所有研究蛋白质二级和三级结构的物理学和化学的方法都能应用于蛋白质的变性和肽链的折叠研究。主要包括光谱和波谱技术,以及与流体力学相关的沉降系数/速度和黏度等。在研究蛋白质折叠时,最常用的是物理学方法。
物理学方法可以捕捉到折叠过程的中间态,研究蛋白质折叠的过程时,使用较多的技术是圆二色性和核磁共振技术,可利用圆二色性比较乳球蛋白肽链的不同折叠状态,由图不难看出折叠中间态、熔球态的特点。在远紫外的圆二色性图谱中,熔球态的图谱与天然构象的图谱大体上一致,说明两者在二级结构上相仿(图7-4A);在反映一些发色团周围环境的近紫外的圆二色性图谱中熔球态的图谱与松散构象的图谱类似(图7-4B),充分说明这些发色团的环境尚属于无规则状态,还需要进一步调整,才能使构象完全转换到天然状态。由核磁共振图谱也可以得出类似的结论,因为在未折叠肽链的图谱(图7-5C)中,谱线比较稀疏,说明分子比较松散,分子中的一些基团彼此相距较远,不存在强烈的相互作用。折叠成熔球态,肽链经塌陷变得更紧密,基团的相互作用增多,谱线较密集(图7-5B)。一旦肽链折叠成为天然的立体结构,图谱中的精细结构也明显增多(图7-5A)。
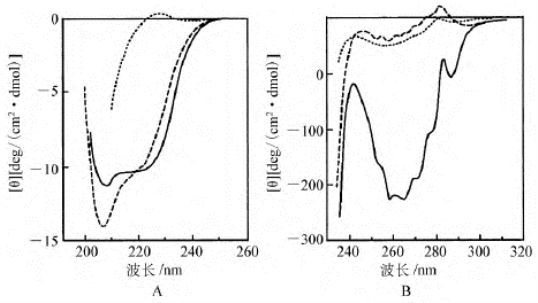
图7-4 乳球蛋白的天然构象、熔球态和完全伸展状态的CD光谱比较
A.远紫外CD谱;B.近紫外CD谱。实线为天然构象;虚线为熔球态;点线为非折叠态
利用圆二色性和一维的核磁共振研究只能得到整个分子折叠状态的总体的改变,仍不能了解肽链折叠过程的细节。重氢交换技术和核磁共振技术的联用,则可能提供折叠过程各个阶段的情况。图7-6为重氢交换技术与核磁共振技术联用的实验操作流程图。为重氢交换技术和核磁共振技术的联用。蛋白质变性后形成了松散的肽链,其中几乎所有肽键中的亚氨基上的氢原子都可以自由地与重水中的氘交换而被替代。然后,肽链发生折叠。此时如果在高pH条件下,假如加入轻水,则部分折叠的肽链中还未折叠的肽段上的氘可以被氢交换,而已折叠的肽段中的氘和氢的交换不能发生。随即改变系统的pH,即pH淬灭,使得氘与氢的交换不能发生。此后,肽链进一步折叠,成为终态。对最终的折叠产物进行核磁共振研究,并与没有经过重氢交换的样品的实验结果比较,即可揭示肽段折叠的先后。如果能有效地、快速地控制pH淬灭时间,就可得到不同时间的折叠中间态,比较它们的结构,就能了解折叠的细节。
如果利用不同的技术测定与蛋白质不同层次结构相关的参数,就可能了解在这点过程中不同时间内,各个层次的结构形成情况。以barstar的折叠研究为例,得到的一组实验结果总结于图7-7中。由图可知,在约1ms时,与分子结合的水分子很快被挤出,肽链变得紧密,由222nm和270nm的圆二色性看,二级结构形成比发色团环境的变化更接近于天然构象,而自由能的改变是最滞后的。
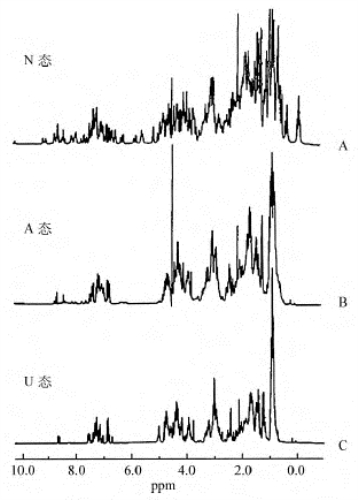
图7-5 乳球蛋白的天然构象、熔球态和完全伸展状态的NMR谱比较
天然构象N;熔球态A;完全伸展状态U
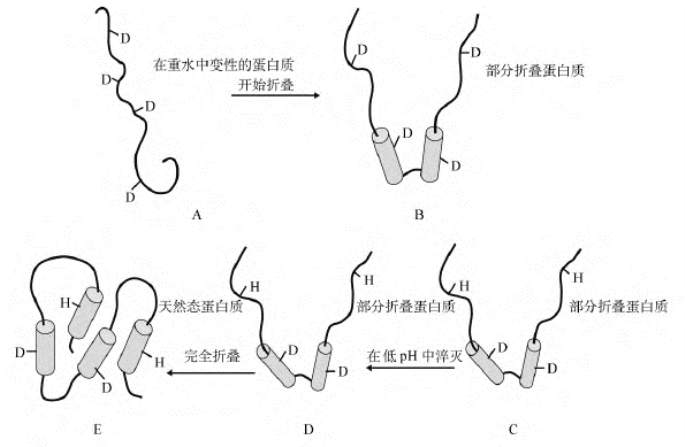
图7-6 重氢交换技术与核磁共振技术联用的实验操作流程
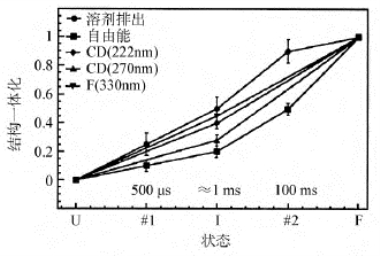
图7-7 不同技术核酸酶抑制药的折叠过程
U、#1.Ⅰ、#2.和F分别为折叠的不同阶段
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















