一、转化
重组DNA分子体外构建完成后,必须导入特定的宿主(受体)细胞,使之无性繁殖并高效表达外源基因或直接改变其遗传性状,这个导入过程及操作统称为重组DNA分子的转化。在基因克隆技术中,转化特指将质粒DNA或以其为载体构建的重组DNA导入细菌体内,使之获得新的遗传特性的一种方法。它是微生物遗传、分子遗传、基因工程等研究领域的基本实验技术之一。
自然条件下,转化现象在原核生物中是较普遍的,很多质粒都可通过细菌接合作用转移到新的宿主内。但在人工构建的质粒载体中,一般缺乏此种转移所必需的 mob基因,因此不能自行完成从一个细胞到另一个细胞的接合转移,如需将质粒载体转移进受体细菌,首先受体细菌需是限制修饰系统缺陷的变异株,其次受体细菌需处于感受态。
在分子生物学实验技术体系中,感受态细胞的制备和转化是基本的实验操作。
感受态细胞(competent cells)是指受体细胞经过一些特殊方法[如电击法,CaCl2、RbCl(KCl)化学试剂法]处理后,细胞膜通透性发生了暂时性的改变,处于能允许外源 DNA 分子进入的状态。
目前常用的感受态细胞制备方法有CaCl2和RbCl(KCl)法。RbCl(KCl)法制备的感受态细胞转化效率较高,但CaCl2法简便易行,且其转化效率一般能达到每微克5×106~2×107转化子质粒DNA,完全可以满足一般的基因克隆实验,故CaCl2法更常用。
CaCl2 法最先由Cohen在1972年发现。其原理是细菌在低温、低渗(0℃,0.1mol/L CaCl2)的溶液中,菌体膨胀成球形,外来的DNA可形成抗DNase的羟基-钙磷酸复合物黏附于细胞表面,经42℃短暂热冲击处理,促使DNA复合物进入细胞,从而实现外源基因的转化。
【材料】
1.细菌 如大肠杆菌DH5 α菌株:R-(限制酶缺陷型)、M-(甲基化修饰缺陷型)、Amp-。
2.试剂
(1)LB 固体和液体培养基(营养培养基)。
(2)氨苄青霉素(Amp)母液:配成 100mg/ml水溶液,-20℃保存备用。
(3)含Amp 的 LB 固体培养基(选择培养基):将LB 固体培养基高压灭菌后冷却至 60℃ 左右,加入Amp母液,调节终浓度为 50μg/ml,摇匀后铺板。
(4)0.1mol/L CaCl2溶液:称取 0.56g无水CaCl2 (分析纯),溶于 50ml水中,定容至 100ml,高压灭菌后备用。
(5)含15%甘油的 0.1mol/L CaCl2 : 称取 0.56g无水CaCl2 (分析纯),溶于50ml水中,加入15ml 甘油,定容至100ml,高压灭菌备用。
3.设备 超净工作台、恒温摇床、离心机、分光光度计、 水浴锅、微量移液器。
【操作步骤】
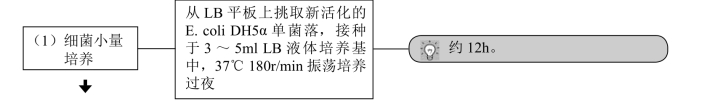
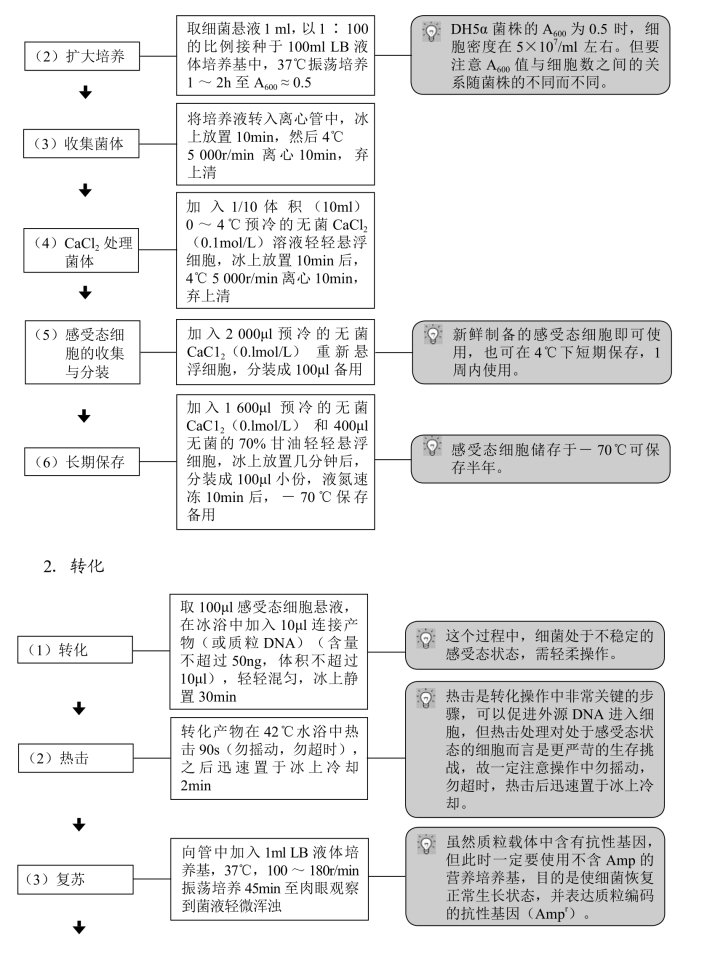
1.感受态细胞的制备及保存
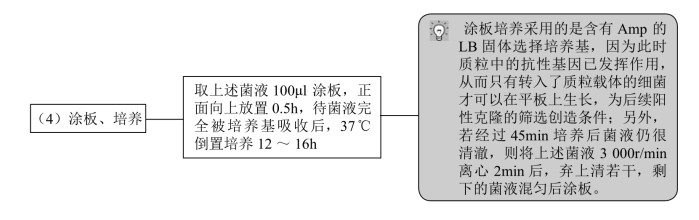
涂板时可同时做2个对照实验。
对照组 1:以同体积的无菌双蒸水代替 DNA 溶液,其他操作与上面相同。正常情况下在含抗生素的LB平板上应没有菌落出现。此组结果用于判断Amp的抗性是否有效,以及实验操作中是否有杂菌污染。
对照组 2:以同体积的无菌双蒸水代替 DNA 溶液,但涂板时只取 5μl 菌液涂布于不含抗生素的LB平板上,正常情况下应产生大量菌落。此组结果用于判断感受态细胞活性和状态是否正常。
【注意事项】
1.细胞的生长状态和密度 最好从-70℃或-20℃甘油保存的菌种中直接转接用于制备感受态细胞的菌液。不要用已经过多次转接,及储存在4℃的培养菌液,即一定使用新鲜、幼嫩的细菌来制备感受态细胞。细胞生长密度控制在每毫升5×107个左右培养液为佳,即一定采用处于对数期或对数生长前期的细菌,密度过高或不足均会使转化率下降。
2.试剂的质量 所用的试剂,如CaC12等均需是最高纯度的,如优级纯(guaranteed reagent,GR)或分析纯(analytical reagent,AR),并用超纯水配制,灭菌后保存于干燥的冷暗处。
3.质粒DNA的质量和浓度 用于转化的质粒DNA应主要是超螺旋态的,转化率与外源DNA的浓度在一定范围内成正比,但当加入的外源DNA的量过多或体积过大时,则会使转化率下降。一般情况下,DNA溶液的体积不应超过感受态细胞体积的5%,1ng的超螺旋态DNA即可使50μl的感受态细胞达到饱和。
对于以质粒为载体的重组分子,其转化效率与重组子的分子量大小有关。一般,重组子分子量大的转化效率低。实验证明,大于30kb的重组质粒将很难进行转化。此外,转化效率也与重组DNA分子的构型密切相关,环状重组质粒的转化率较分子量相同的线性重组质粒高10~100倍,因此重组DNA大都构成环状双螺旋分子。
4.防止杂菌和杂DNA的污染 整个操作过程均应在无菌条件下进行,所用器皿,如离心管、tip头等最好是新的,并经高压灭菌处理,所有的试剂都要灭菌,且注意防止被其他试剂、DNA酶或杂DNA所污染,否则均会影响转化效率或者导致杂DNA的转入,为以后的筛选、鉴定带来不必要的麻烦。
5.整个操作过程均需在冰上进行,以维持细菌的感受态状态,否则将会降低细胞的转化率。
【结果与分析】
1.实验结果及分析 经37℃恒温培养后,在涂布质粒DNA的平板上,可看到有大量的菌落生长,且分布比较均匀。出现此现象的原因是在含有氨苄青霉素的培养基上,质粒转化比较成功,转化子比较多。而且由于质粒中含有抗性基因,受体菌生长良好,所以在平板上可以看到大量的菌落。
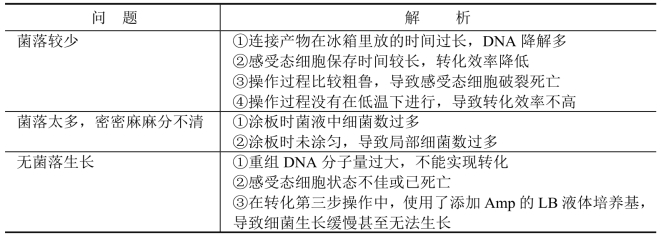
2.常见问题及解析 见表8-3。
表8-3 基因转化常见问题及解析
二、转染
转染是指用病毒或以它为载体构建的外源核酸重组子导入真核细胞的过程,核酸包括DNA(质粒和线性双链DNA),反义寡核苷酸及小分子干扰RNA(small interfering RNA,SiRNA)。基因转染技术已广泛应用于基因组功能研究(基因表达调控、基因功能、信号转导和药物筛选研究)和基因治疗研究。
常规转染技术可分为两大类,瞬时转染和稳定转染。瞬时转染是指外源基因进入受体细胞后,存在于游离的载体上,不整合到细胞的染色体上,因此一个宿主细胞中可存在多个拷贝,产生高水平的表达,但通常只持续几天,需要在外源基因导入细胞1~4d后收获细胞进行分析,多用于启动子和其他调控元件的分析。一般来说,超螺旋质粒DNA转染效率较高,在转染后24~96h内分析结果,常用一些报告系统(如荧光蛋白、β-半乳糖苷酶等)来帮助检测。
稳定转染时,外源DNA既可以整合到宿主染色体中,也可能作为一种游离体(episome)存在。但经过一些选择性标记,如来氨丙基转移酶、潮霉素B磷酸转移酶、胸苷激酶(thymidine kinase,TK)等反复筛选,可以得到稳定转染的同源细胞株。外源DNA发挥作用时间较长,多用于基因治疗等的研究;但其整合到染色体中的概率很低,约为1/104转染细胞,而且线性DNA比超螺旋DNA,转入量低但整合率高。
瞬时转染常采用一些物理、化学的方法,如磷酸钙法、脂质体介导法、电击法(电穿孔技术)、DEAE葡聚糖法、细胞显微注射法等。下面以Invitrogen公司的LipofectAMINETM2000试剂盒转染CHO贴壁细胞为例,作一简单介绍。
【材料】
1.细菌 CHO细胞。
2.试剂
(1)脂质体LipofectAMINETM2000(Invitrogen)。
(2)无血清培养基OPTI-MEM(Gibco)。
(3)转染级质粒。
(4)转染溶液Ⅰ(每孔):240μl 无血清培养基 + 10μl LipofectAMINETM 2000 。
(5)转染溶液Ⅱ(每孔):Xμl 无血清培养基 + 4μg质粒(总体积250μl)。
【操作步骤】
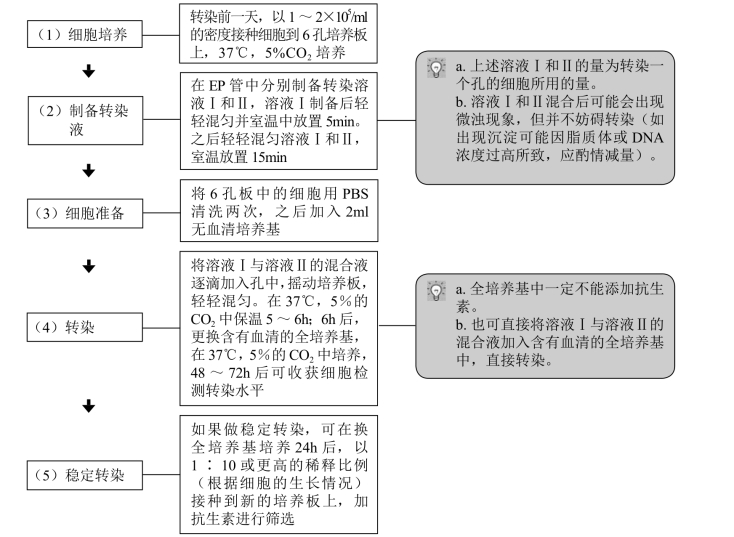
【注意事项】
1. 细胞的状态 做转染时,一定要确保细胞处于最佳的生长状态,这点非常重要。不要使用传了很多代的细胞,例如传代不要超过17代。使用传3代左右的细胞,效果更好。因为传代次数过多,细胞的形态可能会发生变化,严重影响实验结果。
2. 细胞的融合度 应选择在细胞融合度为80%~90%时进行转染,此时转染的效率最高。因为在一定范围内细胞密度增加,其对脂质体的耐受性也增加,转染后细胞受到的影响较小;但当细胞密度过高,会影响脂质体复合物与细胞的充分接触,使有效转染的细胞数目减少,转染效率反而降低。
3. 脂质体的浓度 在一定范围内,脂质体浓度与转染效率呈正比,但超过一定的界限后,由于脂质体对细胞的毒性作用,转染效率随着脂质体浓度的增加呈非线性增加,转染效率明显降低。因此,应通过实验筛选适宜的脂质体浓度或参考相应试剂盒的操作指导。
4. 脂质体与DNA的比率 脂质体与DNA的质量比主要决定了所形成的复合物的电荷性质及稳定性。当脂质体/DNA复合物组成比例合适时,复合物性质稳定,易于被细胞内吞而提高转染效率;当脂质体/DNA复合物比例不合适时,过多的DNA会影响复合物的稳定性,而过多的脂质体则会增加对细胞的毒性,从而降低转染效率。
5. 转染孵育时间 转染孵育时间的长短决定了复合物能否与细胞充分吸附融合,完成外源基因的转入。若转染时间太短则导致转染不充分,转染时间太长则细胞无法耐受脂质体的毒性作用,因此转染时间太短或太长都将影响转染效率。一般转染48h后mRNA表达最高,72h后蛋白表达最高。
6. 无血清培养基 用无血清培养基代替PBS清洗细胞,可以提高转染效率。洗时轻轻沿边缘缓缓加入液体,不要吹吸细胞,通过转动培养板让液体在细胞表面流动和清洗。
后续加入无血清培养基5~6h后更换全培养基。无血清培养基培养时间过长,会对细胞造成毒性损伤。
7. 质粒的质量 要实现高效率转染,使用的质粒一定要纯度好、浓度高、无内毒素污染,浓度不低于0.35μg/μl。
三、病毒的包装
病毒载体是常用的分子生物学工具之一,利用病毒具有传送其基因组进入宿主细胞进行感染的分子机制可将遗传物质带入细胞。这一过程可发生于完整活体(in vivo)或是细胞培养(in vitro)中,在基础研究、基因治疗和或疫苗研制中发挥着重要作用。
目前常用的病毒载体包括反转录病毒载体、腺病毒载体、腺相关病毒载体、慢病毒载体和单纯疱疹病毒载体等。基因工程中使用的这些载体都经过了分子改造,在病毒的基因组中去除了与病毒致癌、毒性和复制相关的基因等片段,在合适的位置插入外源基因,从而发展成为基因传递的工具。因此,这些基因工程的病毒载体都只有感染能力,而没有病毒相关的复制能力,即是复制缺陷型病毒载体。因此,构建好的病毒载体需要在一个特殊的细胞系统中进行增殖,这个细胞即是包装细胞。
包装细胞(packaging cell)是通过基因工程技术对细胞进行修饰,使其产生病毒结构基因所编码的蛋白,为病毒载体包装成为重组病毒提供全面的病毒蛋白。包装细胞并不能转录产生编码完整病毒的基因组RNA,因此,包装细胞本身不能产生任何形式的病毒颗粒。也就是说,包装细胞的目的只是整合质粒,形成带有目的基因的病毒,再用该病毒感染目的细胞。
反转录病毒包装细胞系是通过将gag、pol、env基因导入细胞从而使其成为具有这些基因的稳定细胞系。但这些细胞系并不包含RNA病毒上的包装序列ψ的编码结构蛋白,因此,用包装细胞系产生的是不含gag、pol、env基因的病毒颗粒,从而保证了其在生物制品领域的生物安全性问题。
反转录病毒包装细胞系比较多,如属于NIH/3T3细胞类型的PA317和PT67包装细胞系,来源于转染腺病毒E1A基因的人肾上皮细胞系293细胞,以及转化了SV40大T抗原的293细胞的衍生物293FT和293T细胞。
包装时,为了降低危险性以及形成基因缺陷性的假病毒颗粒,通常设计成2个包装载体或多个包装载体。例如,目前较为常用的是基于HIV-1的第三代慢病毒载体系统,它包括:①编码病毒核心蛋白(gag)和病毒复制所需酶类(pol)的质粒;②编码rev蛋白的质粒;③编码水泡性口炎病毒G蛋白(VSVG)的包膜蛋白的质粒;④携带目的基因的慢病毒载体。通过瞬时转染上述元件到293T细胞可以产生复制缺陷型的慢病毒。
病毒载体经包装细胞包装后产生的是假病毒,即包装出来的病毒并不是活病毒,这种病毒只能感染一次,感染至目的细胞后,目的细胞不能再产生病毒,因为目的细胞没有病毒的胞膜蛋白基因,不能形成病毒颗粒。
需要注意的是包装细胞系对于许多基因一直不能达到高的反转录病毒的滴度,且不同的包装细胞系对不同基因的表达水平有较大的差异。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。















