一、角膜上皮细胞的培养
角膜上皮是一种自我更新组织,增殖和分化之间的平衡维持它的稳定。上皮来源的最佳选择是干细胞,可以从四个途径获得:①角膜缘干细胞培养扩增;②胚胎干细胞诱导分化;③皮肤干细胞横向分化;④骨髓基质干细胞诱导分化。
(一)角膜缘干细胞培养扩增
1.培养液
(1)基础培养基:可以采用的培养基有DMEM、DMEM-F12等培养基,后者中的钙离子有利于细胞的贴壁生长,所以被广泛使用。
(2)血清:血清中含有大量促生长物质,尤其对角膜缘干细胞的增殖有促进作用。但是采用血清培养后,不明成分增多,不便于研究角膜缘干细胞的增殖和分化的调节的因素。因此国外许多学者用无血清培养的方法,用MCDB151基础培养基结合一些添加因子成分来培养角膜上皮细胞收到了较好的效果。
(3)添加因子:角膜上皮细胞体外培养时,常常需要添加各种因子以尽量模拟体内时细胞的营养供应,来提高细胞的增殖活性,保持相对稳定的生物学特性。其中胰岛素、转铁蛋白、氢化可的松、异丙肾上腺素、腺苷、三碘甲状腺原氨酸、表皮细胞生长因子,成纤维细胞生长因子等成分的添加有利于角膜上皮细胞的生长。
(4)饲养层细胞:饲养层细胞不但能够提供角膜上皮细胞多种生长刺激因子,同时饲养层细胞和角膜上皮细胞之间的接触有利于细胞之间信号的传导,促进细胞的增殖和分化。接种在饲养层上的细胞往往能够保持旺盛的增殖能力。一般多采用经射线照射或丝裂霉素处理过的3T3细胞、Swiss鼠胚胎成纤维细胞等作为饲养层。
(5)气液交界面:眼表生理条件下暴露于空气中,气液交界面对上皮细胞的生长分化起到极为重要的作用。采用气液界面的培养方式,上皮细胞能够形成复层结构,而不会因为细胞之间的接触性抑制而死亡。
2.原代培养
(1)材料和溶液
①角膜材料:可以取自人眼、兔眼或者牛眼,人眼材料最好取自胎儿。因为胎儿的角膜上皮细胞的活力高,在体外的增殖能力强,体外培养的时候容易成功。
②特殊器械:虹膜恢复器、尖刀片、角膜剪等。
③角膜上皮细胞培养液,消毒液(1∶5 000的升汞溶液与100U/ml的庆大霉素生理盐水),平衡盐溶液如D-Hanks液,消化液(0.25%胰蛋白酶-0.01%EDTA混合溶液)等。
④细胞培养所需仪器:细胞培养箱、相差倒置显微镜、培养瓶等。
(2)取材
①摘取眼球1只,用升汞溶液与庆大霉素生理盐水消毒液交替冲洗2次,以洗去眼球表面残留的血污并做初步消毒处理;
②无菌条件下,于角膜缘与白色巩膜移行处做一环形小切口,深度1/4~1/3角膜厚度;
③用虹膜恢复器顺切口处插入,沿角膜弧度钝性分离角膜上皮板层;
④待角膜上皮层被完全分离之后,环形剪下角膜上皮层组织。用10mm环钻将角膜上皮板层分成中央上皮和角膜缘上皮组织。将所得角膜缘组织置于培养液或平衡盐溶液中。取材过程中注意防止上皮层干燥,以免影响细胞活性;
采用分离板层的方法进行原代培养一方面可以减少成纤维细胞的污染;另一方面薄层组织块有利于组织贴壁牢固,减少脱壁现象发生;最后薄层角膜组织有利于细胞从组织块中“爬出”,缩短了原代细胞培养时间,提高了培养效率。
(3)接种和培养:角膜上皮细胞的体外培养接种的方法有组织块培养法、消化培养法、饲养层培养法,气液界面培养法等。下面分别对这四种方法进行详述。
① 组织块培养法
A.将中央、周边、角膜缘角膜上皮层组织片用培养液或者Hanks液稍作洗涤。将上皮面朝上,平铺于培养板中。用无菌剃须刀片将其切成1~1.5mm大小的小片组织块(植块)。
B.用无齿小镊子将组织块挑起,上皮面朝下平贴于培养板或培养瓶底壁。
C.37℃恒温箱中静置20~60min,待植块牢固黏附后(即组织块稍干时),再加入少量的培养液。细胞培养箱中静置培养2d,尽量减少培养液的晃动,避免组织块脱落。
D.按常规方法继续培养。3d后开始换液,每周换液2次。相差倒置显微镜下观察细胞的生长情况。
此种培养方法更接近角膜上皮细胞的体内生存环境,细胞之间、细胞和基底膜之间的相互接触和信号传递,都类似于生理状态,所以原代细胞生长比较快,细胞一般7d便融合成单层(图14-3,彩图43)。显微镜下观察细胞可见:中央部角膜上皮细胞大而圆,细胞扁平,呈多边形,细胞的生长速度相对较慢;周边部角膜上皮细胞较中央部上皮细胞小而圆,细胞之间的连接紧密,细胞生长速度较中央部细胞快;而角膜缘上皮细胞形态最小,细胞呈层状向周边铺展,生长速度最快。此外剪碎的组织块也可以接种到饲养层或羊膜上进行培养,细胞的生长状态良好,显示出良好的增殖能力,用于眼表的重建。
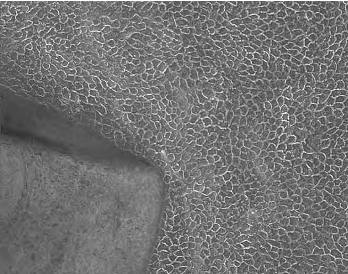
图14-3 组织块培养法(猴角膜缘组织)
② 消化培养法
A.取材后,将角膜上皮层组织的上皮面朝上,平铺于培养皿中。加入0.25%胰蛋白酶-0.01%EDTA混合消化液,于37℃条件下消化15~30min,用含有血清的终止液终止消化,收集细胞到离心管中。培养皿中加入Dispase(1.2U/ml)消化液37℃消化上皮层3h左右。预先用胰酶短时间消化可以增加表层上皮细胞之间的通透性,有利于Dispase向深层角膜上皮组织的渗入,缩短了用酶消化的时间,减少了上皮细胞的损伤和活力的下降。
B.轻轻吹打细胞,使其分散成单个的细胞制成细胞悬液。将细胞移入离心管中。
C.800~1 000r/min离心8~10min。弃上清液,用培养液悬浮细胞,计数。
D.消化后的细胞可以直接接种到培养瓶中培养,也可以接种到饲养层或羊膜等培养载体表面。
E.加入适量上皮细胞培养液,37℃,饱和湿度、5%CO2、95%空气的细胞培养箱中培养。每周换液2次。相差倒置显微镜下观察细胞的生长情况。
讨论:消化培养法往往得到的细胞比较纯(图14-4,彩图44),杂细胞少。胰酶结合Dispase酶消化细胞既减少了其他杂细胞的污染,又保证了角膜上皮细胞良好旺盛的增殖能力。
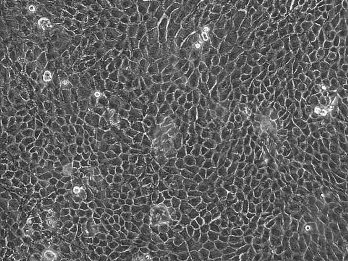
图14-4 酶消化法培养(人角膜缘上皮细胞)
③ 饲养层培养法
A.3T3饲养层细胞的制备:在3T3细胞接近融合状态时,培养液中加入10μg/ml丝裂霉素C,继续培养2h。
B.用培养液洗3次,最后一次于37℃下洗10~20min。
C.按常规方法用胰蛋白酶消化收集3T3细胞,以细胞密度2.5×104个/cm2种植在培养瓶中。
D.将角膜上皮组织块或消化后角膜细胞,接种到预先准备好的饲养层上进行细胞培养。
讨论:处理后的饲养层细胞失去了增殖能力,却保存了细胞分泌功能。可以提供角膜细胞生长所需的各种营养因子,还可以通过细胞和细胞的接触传递细胞增殖、分裂信号,此外还能够抑制其他杂细胞的生长,有利于角膜上皮细胞的纯化。接种在饲养层上的角膜上皮通常生长旺盛。
④ 气液界面培养:气液界面培养是将消化后的细胞或组织块放在有气液界面条件下进行培养的一种方法。良好的气液界面有利于角膜上皮细胞的增殖和分化,气液界面的形成可以用自制的培养支架,让上皮细胞暴露于空气中;也可以用旋转培养法进行。气液界面培养促进细胞形成复层结构和细胞间连接紧密。
(4)细胞分离纯化:在细胞原代培养过程中,不可避免的存在杂细胞的污染。少量的杂细胞不仅对角膜上皮细胞无害,反而有利于细胞的增殖;而且临床上眼表重建和生物角膜的构建不需要完全纯化的角膜上皮细胞。但是如果培养的细胞中其他的细胞占优势时往往会抑制角膜上皮细胞的增殖。这时需要对细胞进行分离纯化。除了上述的分离角膜板层减少杂细胞的污染外,在细胞培养过程中还可以用以下的方法对细胞进行纯化:
①Dispase消化法:此种消化的特点是Dispase作用于上皮基底膜的结合处,仅破坏半桥粒结构,对角膜上皮细胞的损伤较少,利用此法较好保持了细胞活力的同时又可获得较纯的角膜缘上皮细胞。因此Dispase消化法是一种较好的方法,在国外研究中得到了广泛的应用。
② 机械刮除法:对局部聚集生长的杂细胞在显微镜下进行刮除,去除大部分杂细胞的污染。此种方法只是粗略去除杂细胞的生长优势,减少其对角膜上皮细胞的竞争。
③差异黏附法:此种方法是利用细胞的黏附力不同,而使细胞得以分离的一种方法。细胞传代时可以利用不同细胞对胰酶的反应时间不同,角膜上皮细胞由于细胞之间、细胞和瓶壁之间连接非常紧密,往往需要较长消化时间;而其他细胞如成纤维细胞所需的时间短,利用此差异使细胞纯化。另外不同细胞接种贴壁时间也不尽相同,观察细胞贴壁时间的差异也可以对细胞进行初步的分离纯化。
④其他:此外还有Ⅳ型胶原差异黏附法、5-FU毒性选择法、n-庚醇处理法、密度梯度离心等方法用于角膜缘干细胞的分离和纯化,效果也不尽相同。
(5)细胞传代、冻存和复苏:体外培养的角膜上皮细胞接近融合成单层,如果不进行气液界面培养,多需要进行传代培养。一般选择细胞的对数生长期进行消化传代。吸去培养液,用PBS液轻轻漂洗细胞,去除残存培养液中的血清,加入0.25%胰蛋白酶-0.01%EDTA混合溶液,倒置显微镜下观察细胞的消化程度。待细胞开始松散,变圆时,倒去消化液,加入含血清的培养液,用吸管轻轻吹打瓶壁,让细胞从瓶壁上脱落下来,收集细胞到离心管中,800~1 000r/min离心8~10min,后去掉上清液,用培养液重悬细胞,按照合适的密度(通常按1∶2传代)接种到新的培养瓶中。放入细胞培养箱中37℃、5% CO2、95%空气饱和湿度培养。
原代细胞的消化往往需要较长的时间,除了保证胰酶的效力外,细胞漂洗要彻底,必要时37℃消化可以缩短消化时间,有时为了避免细胞长时间接触胰酶造成的损害,分段消化法也是可取的。
①细胞冻存:可以对原代细胞进行保种,以备以后使用。细胞传代和冻存的最佳时机是70%~80%融合的对数生长期的细胞在换液后2h左右,常规消化细胞后,移入离心管,800~1 000r/min离心10min,弃清液,加入冻存液。冻存液中二甲基亚砜:上皮细胞培养液=1∶9、细胞量为l×l06/ml,分装入冻存管中,将冻存管放入自制的塑料泡沫盒中,密闭封好后放入-86℃冰箱中过夜保存,次日转到-196℃液氮中长期保存,并做好记录。定期检查液氮罐中液氮量,保证罐内的温度。
②细胞复苏:准备37~40℃温水一杯,将冻存细胞从液氮中取出后立即放入水浴中,不断摇晃加速细胞的复温,力争在30s内使冻存管中的冰完全融解。将冻存管中的细胞悬液移入事先加有5ml培养液的离心管中,800~1 000r/min离心8min,去除冻存液常温下对细胞的毒性作用。离心后去除上清液,用上皮细胞培养液重悬细胞,按照适当的密度将细胞接种于培养瓶中,常规换液培养,倒置显微镜下观察细胞复苏后的生长状态。
冻存细胞的复温速度对细胞的活性影响非常大,所以复苏时应该在最短时间内让冰晶融解。一般细胞复苏后的第2天换液一次,减少残留的二甲基亚砜对细胞的毒害作用。
(二)胚胎干细胞诱导分化
胚胎干细胞(embryonic stem cell,ESC)具有分化成各种组织细胞的潜能。众所周知,微环境的调控是干细胞增殖和分化的外部原因。在体外最大限度的模拟体内微环境,能诱导ES细胞向某一特定方向分化。目前,应用胚胎干细胞定向分化为角膜上皮细胞还处于起步阶段,需要进一步深入研究,以下实验方法仅供参考。
1.兔角膜缘上皮细胞体外诱导ESC分化 ES-D3,ES-BALB/c,ES-GFP(转染绿色荧光蛋白基因的胚胎干细胞,图14-5,彩图45;图14-6,彩图46)接种在经丝裂霉素处理过的小鼠胚胎成纤维细胞饲养层上培养,保持其未分化状态。诱导前将ESC移出饲养层,传2~3代去除饲养层细胞。兔角膜缘上皮细胞2~4代用于诱导ES细胞的分化。
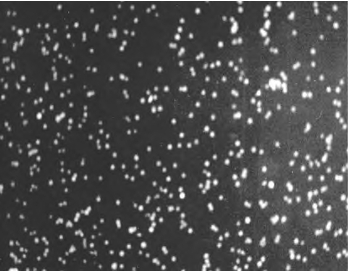
图14-5 消化后的ES- GFP细胞

图14-6 ES- GFP克隆
取2~4代角膜上皮细胞接种于六孔Transwell(Transwell为一双层共培养系统,两层之间由带孔的多聚碳酯膜滤膜隔开,图14-7,彩图47)上层培养板中,2d后,待角膜上皮细胞完全贴壁,70%~80%融合后,将ESC接种于Transwell下层培养板中,接种密度5×105细胞/孔,采用无LIF ES细胞完全培养基,每日半量换液。倒置相差显微镜下观察ES细胞形态。共培养96h后,免疫组化显示:下层分化的ES细胞大部分细胞AE5(CK3/12)阳性显色(图14-8,彩图48)。透射电镜显示诱导分化后ES细胞表面大量微绒毛,细胞间可见胞突及凹陷镶嵌形成紧密连接,均为上皮细胞较典型特征(图14-9)。

图14-7 Transwell培养板

图14-8 诱导分化的ESC AE5(+)
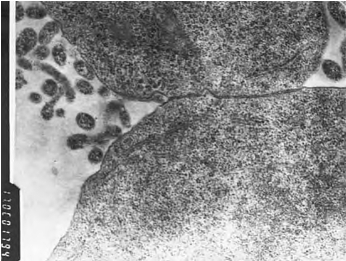
图14-9 诱导分化后ESC间紧密连接
2.羊膜对ES细胞的诱导作用 羊膜组织对ES细胞也有一定的定向诱导作用,与羊膜组织共同培养的ES细胞形态向上皮样细胞转化,羊膜与RA共同作用可诱导ES细胞向上皮细胞转化并表达细胞角蛋白。
(1)人羊膜的取材及处理(图14-10):无菌状态取健康产妇剖宫产胎盘,剥离羊膜,钝性分离去除绒毛膜,2 000U/ml庆大霉素生理盐水冲洗干净血污,用剪刀剪成约5cm大小,基底面朝下平铺在硝酸纤维素膜上,浸泡在1 000U/ml庆大霉素生理盐水中,30min后,在超净工作台中将其移入盛有DMEM培养基的平皿中。无菌条件下将羊膜剪成比6孔培养板孔径稍大的圆形,平铺在6孔培养板底部,上皮面向上,覆盖整个孔底部,倒置于37℃、5%CO2、饱和湿度的培养箱中。4h后,待羊膜贴附后,翻转培养板,加入不含LIF的ES细胞培养基,培养过夜,次日接种ES细胞。
(2)ES-GFP细胞接种于羊膜表面培养:将生长良好的ES细胞消化成单细胞悬液,用无LIF的ES细胞培养液调细胞浓度5× 105/ml。接种1ml于铺被好的羊膜表面,加足量无LIF的ES用完全培养基。每日半量换液1~2次。
接种在羊膜上的ES-GFP细胞贴附于羊膜呈集落生长,1d即可形成小的克隆,2~3d克隆逐渐增大,集落边缘不够清楚,表面变粗
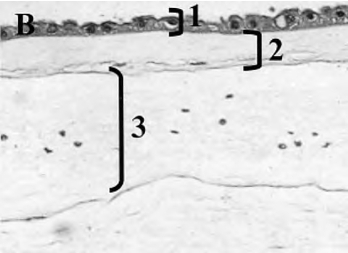
图14-10 人羊膜组织
注:1.羊膜上皮;2.基底膜;3.无血管基质
糙,有小圆形的隆起,集落内细胞界线模糊;4~5d,克隆继续增大,细胞堆积隆起更明显,有一部分细胞集落变得较大而扁平,集落内细胞界限较清楚,多角形、菱形细胞镶嵌。免疫组化显示羊膜上分化的ES细胞p63阳性(图14-11,彩图49)与CD29阳性。
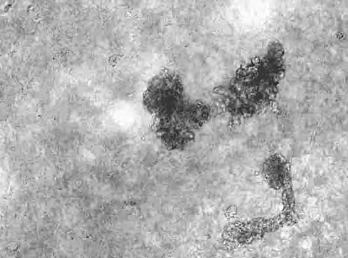
图14-11 羊膜上分化的ESC p63(+)
3.角膜缘基质的局部诱导作用 用促进分化剂RA(视黄酸)启动胚胎干细胞分化后,将胚胎干细胞与表层角膜缘基质共同培养,ES细胞形态向上皮样细胞转化,容易形成单层融合成片结构,进行细胞角蛋白的免疫组化鉴定,发现分化细胞表达细胞角蛋白,证实角膜组织与RA共同作用可诱导ES细胞向上皮样细胞分化。但是分化细胞传代能力弱,推测与培养条件有关,可能类似于胚胎干细胞建系中传至4~6代的情况。
4.相关细胞因子的诱导作用 与表层角膜缘基质共同培养的ES细胞,培养基中添加KGF、EGF等细胞因子后,虽然分化细胞形态向上皮样细胞转化,但细胞不表达角蛋白,说明ES细胞的定向诱导不是由单独一种因子来完成的。
5.晶状体上皮细胞在维持角膜缘干细胞功能方面存在一定作用 胚胎发育过程中,由晶状体上皮诱导其表面的细胞分化,部分细胞继续分化形成角膜上皮,而部分位于角膜缘处细胞保持静止状态,则成为成体组织中的角膜缘干细胞。因此对晶状体细胞在维持角膜缘干细胞特性方面的作用值得探讨。晶状体上皮细胞作为饲养层可使ES细胞表达角膜缘干细胞标记p63。
成体角膜缘上皮细胞、角膜基质均存在着调控角膜上皮细胞分化发育的微环境。成体角膜缘上皮及角膜缘基质存在细胞因子网络,包括TGF-α、IL-1β、PDGF、IGF-I、TGF-α、LIF、bFGF、KGF、HGF、M-CSF及IL-8,在角膜胚胎发育、创伤愈合、及某些上皮相关疾病过程中调节角膜缘干细胞及角膜上皮细胞的增殖、分化、移行等生物活性。角膜基质除通过ECM发挥直接接触性调控基质外,还含有许多自分泌和旁分泌的细胞因子及其受体,它们共同构成了复杂的细胞因子调控网络。
采用角膜缘上皮细胞,利用双层Transwell非接触共培养系统结果显示,分化的细胞光镜、电镜检查均显示具有典型上皮细胞形态结构,呈多角形,形态单一,细胞群体呈膜状生长,大量的微绒毛及细胞间紧密连接,并表达角膜上皮特异性标志CK3/CK12。提示角膜缘上皮细胞和晶状体上皮细胞产生的分泌性活性因子具有诱导ESC向角膜上皮细胞分化的能力。诱导角膜缘干细胞及角膜上皮细胞的分化需要更多因素的共同作用,这一过程可能与局部细胞因子的类型及浓度密切相关。
(三)成体干细胞横向分化
来源于各种组织的成体干细胞事实上并未定型,它们的分化潜能远较先前所认为的要宽,一旦处于一个崭新的环境中,他们可能分化为其他类型的细胞,生物学家们称这种现象为成体干细胞的可塑性(plasticity)或横向分化(transdifferentiation)。在当前,多国政府迫于伦理道德上的压力禁止科学家进行胚胎研究,因而研究成体干细胞的可塑性更加有意义。在先天性无虹膜症患者,角膜缘干细胞缺如,应用自体的成体干细胞可塑性进行重建眼表可以避免免疫排斥的发生。目前人们多根据细胞形体和细胞特异性表面标志来判断成体干细胞是否分化成了其他细胞,还没有充分的证据表明这些细胞也具有相应的功能。
1.皮肤干细胞分化为角膜上皮细胞
(1)皮肤干细胞的培养扩增:将取得的皮肤标本去除皮下组织,剪成1~2mm宽的皮条,用0.25%胰酶浸泡,置于4℃过夜,获得消化下来的皮肤上皮细胞,用皮肤上皮细胞培养液进行培养传代,获得1~4代的细胞,再用Ⅳ型胶原黏附法获得皮肤干细胞。
(2)角膜基质片的制备:取得兔角膜后,先用普通消化液(将0.25%胰酶以1∶1的比例加入0.02%EDTA)浸泡,37℃0.5h,再用Dispase浸泡,37℃消化2h。每次消化后用PBS洗去消化下来的细胞。在解剖显微镜下观察,确保角膜上皮细胞完全被消化下来,无残留。
(3)接种:将获得的1~4代人皮肤干细胞种植在去上皮的兔角膜基上,每个角膜片上种植(0.5~1)×105个细胞,37℃培养。使用的培养液仍然是皮肤上皮细胞培养液。5~6h后进行气液界面培养,连续10d。免疫组化显示K3/K12(角膜上皮特异性)和K19(皮肤干细胞的特异性表面标志,角膜缘干细胞的标志之一)均呈阳性。
2.诱导骨髓间充质干细胞向角膜上皮细胞分化 从胚胎干细胞诱导分化来的角膜上皮细胞和神经细胞有以下不足:①细胞来自异体,仍然存在免疫排斥反应的问题;②用来诱导分化的胚胎干细胞最好不是长期传代的细胞,以便于诱导,结合目前干细胞研究的最新进展,诱导骨髓间充质干细胞定向分化的研究正在进行,经诱导的骨髓间充质干细胞无论是从形态学还是特异性蛋白表达,均符合神经细胞特征,为过渡到利用患者的自体骨髓间充质干细胞定向诱导分化为角膜上皮细胞和神经细胞,构建类自体生物眼组织奠定基础。
二、角膜基质细胞的培养
角膜基质细胞可以从角膜实质层获得:去除上皮和内皮层后,基质组织块置DMEM加10%胎牛血清和抗生素的培养基中培养,上皮培养被基质细胞污染后改为上述培养基也可获得,传代后上皮细胞因营养不足而被淘汰,即可获得较纯的基质细胞。
三、角膜内皮细胞
角膜内皮细胞培养:沿角膜缘环行剪下角膜 ,将角膜内皮和后弹力层撕下,用庆大霉素生理盐水洗2次,加D-MEN培养液配制的胶原酶(200U/ml)溶液,37℃下消化48h。分装接种于塑料培养瓶。加含胎牛血清和添加因子的培养液,置5%CO2培养箱培养,倒置显微镜下观察细胞生长情况。细胞贴壁后,每3d换液1次。细胞生长融合接近融合时,用0.25%胰蛋白酶消化进行细胞传代培养。
在角膜内皮细胞方面,培养体系还不够成熟,培养液成分和相关促分化、抑制凋亡的细胞因子的筛选有待于进一步研究。Kofff等(1998)设计的三维球状培养模型,克服了内皮细胞单细胞悬浮培养时,细胞很快凋亡的难点;Blake等(1997)采用牛角膜内皮细胞和基质包被培养皿培养人角膜内皮细胞,结果细胞不但可以正常生长,而且形态、核型均正常,表明牛角膜内皮细胞和基质能够促进人角膜内皮细胞增殖。研究发现人角膜内皮细胞上有bFGF、FGF受体(flg型)、EGF受体和TGFβ1表达,合适的培养条件和添加相关细胞因子,如KGF、EGF、HGF、VEGF、FGF-2、bFGF均能促进角膜内皮细胞增殖,维持正常细胞形态。Engelmann等(1995)报道利用他们设计的F09sr培养液,可以保证角膜内皮细胞融合时的正常形态。Bohnke等(1998)介绍他们培养20代以上(1年以上)仍有NSE染色,并保持其鹅卵石样外观。
免责声明:以上内容源自网络,版权归原作者所有,如有侵犯您的原创版权请告知,我们将尽快删除相关内容。














